NIR实现药品的快速、无损分析

图1. 近红外固体探头用于快速、无损原料鉴别。
近红外光谱法(NIR)是一种快速、无损的分析技术,它能够提供样品的化学和物理信息。近红外技术与多元数据分析结合起来为定性和定量分析开创了很多新的前景。本文主要阐述了基本的近红外原理及近红外技术在制药行业的应用,包括在制药行业的规章规程符合、原料鉴定、各种剂型的无损分析和过程监控等。
最近十几年,在制药行业中,近红外分析在原料鉴定,产品品质控制和过程监测方面已经得到了广泛的接受,这主要得益于近红外分析技术与其他技术相比有许多独特的优点。例如,样品几乎不需要预处理;光纤的广泛使用可以实现远程分析样品;一张简单的光谱图可以得到多种化学和物理参数等等。
近红外光谱的基本原理
近红外区域按美国材料与试验学会(ASTM)定义是指在780~2526nm范围内的电磁波。该谱区的吸收谱带都是中红外基频吸收的倍频与合频吸收,在近红外光谱区产生吸收的官能团主要是含氢基团,包括C-H、O-H、S-H和N-H等。近红外光谱的吸收谱带比相应基频振动的中红外谱带要弱10~100倍,谱区相对比较宽,互相重叠。然后,较低的吸收系数使得近红外谱区对样品有更深的穿透深度。这是该分析技术的一个优势,因为这样可以直接分析吸收较强甚至发生高散射的样品,例如对混浊液体和固体样品无需任何前处理进行透射和反射方式的直接采样。
制药行业的法定规章
无论是在学术上还是在工业应用上,关于近红外技术已经有大量的研究论文发表。然而,在极度规范的制药领域中,每项技术都是在权威认证机构的认可下,仅仅从事一些简单的常规分析。实际上,大部分药典已经收载了近红外技术。欧洲和美国药典都包含了关于近红外技术的章节,当然,这些部分的内容主要是关于仪器性能指标的要求,包括波长范围、重现性,吸光度线性、信噪比等,而关于建立和验证应用方法的指导说明则非常有限。
cGMP指导方针中的21 CFR part 2 11对仪器资质验证过程的法定要求有详细描述,分别是设计确认(DQ)、安装确认(IQ)、操作确认(OQ)、性能确认(PQ)。为了实现这些要求,ASTM提供了对关于建立NIR光谱仪器性能测试方法的明确说明,包括合适的标准物质和多变量校正方法。英国皇家化学会分析方法委员会在一篇专门的报告中也提供了评价NIR光谱仪器的指导方针。
#p#
图2. 近红外漫透射分析片剂和胶囊。
很多制药企业已经成功地将近红外方法作为原料鉴定分析的常规方法,这主要是基于大部分药典允许药厂可以使用不同于药典的方法,只要这些方法能够满足必须的验证参数,例如专一性、线性、范围、准确度、精密度、重现性、检出限等等。这些内容在USP第1225章节和ICH指导规范Q2A和Q2B中有详细说明。但是目前的情况是,只有很少的NIR定量分析方法获得了规章认可。这主要是因为“非分离”多变量的近红外方法,与传统的分离检测单变量的色谱分析方法有很大的不同。Moffat等人针对这些方面做了比较深入的讨论,并在2000年发表了一篇非常优秀的论文。作者以近红外方法分析扑热息痛片剂为例,谈到了如何使NIR方法能够最好地满足ICH的要求。2001年PASG(UK Pharmaceutical Analytical Science Group)发表了关于“制药行业中建立和验证近红外方法的指导规范”,里面即涵盖了近红外方法的独特性和专属性,同时也保持了与ICH Q2A和Q2B中关于传统方法验证要求的互补性。PASG中的指导规范针对硬件和软件均给予了详细的说明,给制药行业和药品规范管理部门在近红外定量分析方法认证方面提供了极大的帮助。(PASG指导规范见www.pasg.org.uk/NIRmay01.pdf)
制药行业通过采取质量建构(制定标准操作程序SOP、制定法规、细化标准)、颁发质量合格证书或质量认证(试运行、IQ、OQ、PQ)和质量检验(在生产过程中或产品最后发布时)等方法的综合运用来确保一种药品能够符合原定的外观和药效。但是这些实际上都是基本建立于离线检测,仅适用于证明小部分、随机样品的产品合格性。美国FDA逐渐认识到传统的质量管理方法可能是药品问题潜在的主要原因,并于2002年颁布了经过修改完善的cGMP指导文件,其中包括支持过程分析技术(PAT)的采用。PAT被定义为是通过对原材料和处于加工中的材料的关键性质量品质和性能特征进行实时监测,设计、分析和控制加工制造,来确保最终产品品质。由于近红外光谱分析技术非常适合在线测量,因此是一个非常重要的PAT工具。目前要将近红外在过程控制中的优势完全发挥出来,还面临许多挑战,包括硬件的设计,各种药品管理规范的认可等等。但相信,不久的将来,NIR一定会作为重要的PAT工具,广泛应用于制药行业。
原料及中间体的鉴别和鉴定
近红外光谱法可以用于原料药和辅料的分析。早在1988年,Rostaing等就应用傅立叶变换红外光谱和近红外漫反射光谱对制药原料进行了快速鉴别。1995年,Van等首先建立了各种原料的标准指纹近红外谱库,对来源不同、在化学或物理性状方面只具有微小差异的原料,实现了正确判别。Smola等也报道了近红外在原料药判别分析上的应用。使用近红外光谱法对原料进行化学鉴定通常采用建立该原料的光谱库。如果该原料的谱图库建立的比较好,也就是这种原料的近红外光谱图同时包含了其化学和物理信息,因此可以用来作为原料品质分析。在1990年早期,Viels等用NIR建立一个新的定性方法,称作“一致性(conformity)”方法,并且引入了一个新的品质参数——一致性指数(Conformity Index, CI)。他们成功用这个方法替代了药典方法对氨苄青霉素三水合物的鉴别。值得一提的是,这是首个被美国FDA认可的用于测试大批用于人类药品的近红外方法。
#p#各种剂型的无损分析
近红外光谱技术在药物制剂的分析方面应用已有了很大的发展。在早期,近红外光谱法与传统分析方法一样,需要用溶剂提取制剂样品中的待测成分后进行测定。随着近红外方法的发展,计算机科学和化学计量学的进步,可以用近红外光谱法对制剂样品进行无损分析。
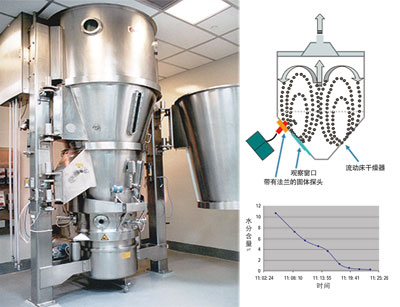
图3. 近红外在线监控流化床干燥过程。
片剂
最早使用近红外光谱对片剂药物进行含量测定的是FAD的Sherken,他用近红外法测定一系列的甲丙氨脂标准溶液,建立了计算甲丙氨脂含量的校正方程。另外近红外在透过包装材料快速无损鉴别片剂的活性成分或辅料是一大优势。Dempster等人成功地用近红外技术透过包装材料鉴别了不同剂量的安慰剂(2、5、10和20% w/w)。目前已经有很多关于近红外技术快速测定片剂中活性成分的报道。
胶囊
硬胶囊是一种非常多样化的剂型,它里面可以填充各种配方形式的药物,活性成分含量、水分含量和溶出度是控制胶囊质量的重要指标。近红外法可以通过一张谱图得到所有这些信息。1987年Lodder等利用近红外光谱鉴别了掺杂和没有掺杂的胶囊,这是首次使用近红外方法无损分析胶囊的报道。在最近几年里,Reich等通过了大量的数据说明了近红外透射和反射法在控制胶囊质量方面有非常大的潜力。
软胶囊与硬胶囊相比,它们一般是完全被填充成型的封装成一个连续的整体。囊壳厚度一般为500μm左右。关于用近红外分析软胶囊的报道相对较少,主要是由于以下原因:1)囊壳的颜色在近红外区有很强的吸收。2)光谱的采集受形状的影响比较大,例如囊壳的厚度、接缝的影响等。3)囊壳的水分跟外界环境有很大的关系。Reich等使用近红外光谱同样在软胶囊上做了很多的工作。他们的实验数据表明了解软凝胶壳的水分和可塑性变化对近红外光谱的影响是将近红外技术用于软胶囊品质分析的先决条件。(如文字多先删)
冻干产品
冻干制剂通常是针对一些易水解的药物,用于提高其稳定性。因此水分的含量是冻干制剂一个非常重要的指标。传统测水分的方法非常耗时,例如Karl Fischer滴定。而采用近红外光谱法不仅快速而且可以直接透过玻璃瓶进行无损分析。Derksen等已使用过近红外光谱法测定药品的稳定性,将水分含量和活性药物的含量进行关联来确定药品的有效期。Lin和Hsu用五种不同的蛋白质来评估近红外光谱法在不同的算法下测量水分的准确度。虽然使用近红外光谱法在分析冻干产品上还有很多的问题需要克服,但是可以预见在不久的将来这种方法在这种类型产品中的应用会越来越成熟。
#p#过程监测和过程控制
近红外光谱法分析的最大特点是操作简便、快速,可不破坏样品进行原位测定,可不使用化学试剂,不必对样品进行预处理,可以直接对颗粒状、固体状、糊状、不透明的样品进行分析。这些特点为制药行业生产过程中的监测和控制提供了一个非常好的平台,也是PAT在实时测量和“质量来源于设计”理念中的应用。
混合过程
混合是固体制剂或半固体制剂生产中的一个重要环节,混合的最终目的是为了让所有的组分达到均匀的分布。传统的方法是取样后进行UV或HPLC分析。这种方法比较耗时,并且往往只是测量活性成分而忽视了其他的组分分布情况。而近红外光谱不仅同时获取了各种组分的化学信息同时也包含了样品的物理特性。Sekulic等最早报道了采用近红外光导纤维在线监测混合过程。Berntsson等在混合过程中采用近红外光谱法实时监测做了比较详细的研究。他指出采用色散型仪器测量移动的非单一成分样品会导致“虚假”光谱,而傅立叶型近红外光谱对这类样品比较合适。
干燥
因为水的O-H的吸收振动在近红外区比较强,因此采用近红外光导纤维技术在线优化控制干燥的时间终点是一个很好的选择。White在微波真空干燥过程中使用了近红外在线技术控制过程的终点,他主要使用1410、1930和1630nm的吸收值来建立模型。当样品水分少于6%的情况下,预测样品的SEP为0.6%。并且该论文指出水分预测值跟样品本身没有关系,因此该模型的适用性非常好。Morris等使用近红外在线监测流动床干燥过程,并将整个过程的不同的阶段通过可视化的形式反映出来。其实目前已经有很多文章描述了近红外在不同干燥过程的应用,包括微波真空干燥、流动床和冷冻干燥等。此外,近红外光谱法对整个干燥过程还提供了很多新的信息,例如解析速率和干燥过程完成的稳定状态值。这些结果均清晰地展现了干燥过程中的产品状态。
制粒过程
片剂的生产过程中通常需要制粒工艺来改善粉末的流动性和可压性,这个过程对后期的压片至关重要。使用近红外光谱法可在线监控并确定过程终点,可以为制粒过程提供颗粒粒径和水分含量的实时数据。List和Steffens在1996年发表了一篇关于近红外光谱法在线监控湿法制粒的过程。整个湿法制粒工艺会按一定的时间间隔停止后,用近红外光纤采集光谱。最后用PLS算法建立了安慰剂混合物的水分定量模型。Watano等最早报道了使用近红外光谱法在线监控流化床制粒过程中的水分含量,他们还考察了液体流动速率和过程中空气温度的影响。Goebel和Steffens使用傅立叶近红外光谱仪在流化床制粒过程中在线检测颗粒大小和湿度,并采用Karl Fischer滴定法和激光衍射法分别作为水分和粒径的参考数据。然后用PLS算法建立了一个这两种指标的定量模型,结果表明采用近红外光谱法测量粒径要比测定湿度具有更大的挑战性。
包衣
包衣在制药行业中是为了改变药片的口味而易于服用,或者是控制药物的溶出速率。包衣的好坏与厚度和均匀性密不可分。目前包衣厚度和均匀性的评估主要是通过称重和间接的溶出测试。对于PAT而言,这种方法有两个主要的缺点:第一,增重法的测量没有考虑到包衣过程中药片质量的损失,这样将会导致该方法的准确性;第二,溶出测试属于间接,耗时的分析方法。近红外在线监测包衣过程同样具有很大的优势。Kirsch等发现片剂样品的近红外光谱的变化和包衣的厚度之间存在相关性。他们对近红外光谱法在包衣监测中的应用做了进一步的考察。在用乙基纤维素(EC)或羟丙基纤维素(HPMC)进行包衣的过程中,按一定的时间间隔取样,测定片剂样品的近红外光谱。采用二阶导数和多元散射校正两种方法进行处理,然后用主成分回归建立包衣厚度的模型。为了控制药物活性成分的释放,研究人员采用了一种以包衣技术为核心的制剂新工艺,即在缓释药物片心外包上一层含有快速释放药物的包衣。这需要使用一种能够对外层包衣中药物活性成分进行快速、非破坏的定量分析方法,对这种高精度的包衣过程进行监控。Buchanan等选择了近红外光谱法,所得结果与HPLC测试结果一致,这表明能够用近红外光谱法更加快速有效地对新的包衣工艺进行质量评价。
展源
何发
相关文章
-

NIR实现药品的快速、无损分析
2020-05-27
-

NIR在工业分析中的应用
2020-05-27
-

NIR在工业分析行业中的应用
2020-05-27
-

高效无损检测胶囊中的铬
2020-05-27
-

无损快速检测胶囊中的铬
2020-05-27
-

药物分析中的高效液相色谱
2023-02-08
-

灵敏、高效地分析PAA
2020-05-27
-

奶粉检测的NIR模型
2020-05-27
-

药物的分析方法验证、转移和确认
2020-07-17

加载更多