纳米药物的表征和质量控制 纳米药物的质量控制指标及检测方法
纳米药物的表征和质量控制
与传统药物相比,纳米药物具有独特的优势,全面、科学、合理地表征纳米药物,制订合适的药品质控指标,建立相应的检测方法是一项非常重要的工作。本文讨论了其中的两个重要参数:粒度及粒度分布、药物载体的包封率以及相应的检测方法。
纳米微粒的粒子尺寸已接近光的波长,纳米微粒有大量的界面或自由表面,表面有很强的活性,可产生特殊的光学、热学、力学和磁学特性,同时纳米微粒间存在着或强或弱的相互作用。
纳米药物不是传统的分子药物(Molecular Medicine),而是颗粒药物(Particles Medicine)。与传统的分子药物相比,纳米药物的最大优点在于:容易进入细胞而实现高效;可链接或载带的功能基团或活性中心多;便于生物降解或吸收;易于实现药物的缓控释放等功能。因此,纳米药物主要用于:⑴改善难溶性药物的口服吸收;⑵靶向和定位释药(targeting drug system,TDS);⑶药物控释;⑷生物大分子的特殊载体等。
目前的纳米药物可分为两类:全新的纳米药物和纳米载体。全新的纳米药物是指直接将原料药物加工成的纳米粒,纳米载体系指溶解或分散药物的各种纳米粒,如纳米脂质体、聚合物纳米囊、纳米球、聚合物胶束等,是利用纳米技术改良的传统分子药物。纳米药物的分析集中在结构和性质的表征,如粒度及粒度分布、分散性、分散稳定性、表面电性能、表面成分及价态、表面自由能和结构等,了解纳米药物的结构和性质,有利于探索它们的生物特性和药理药效学机理。
新药物载体和药物新剂型纳米载体的分析和质量控制不同于它们的前体药物,由于药物颗粒的直径及其分布与药效、药物载体的性质、分布与疗效、药物载体的载药量、包封率、给药剂量、给药方式等都密切相关,因此,须对药物粒径及粒度分布,药物载体性质、载药量和包封率等进行分析和控制。此外,某些特殊的纳米药物如放射性纳米药物的活度等也需进行控制,对纳米药物药理学和药代动力学的研究需采用更高选择性和灵敏度的分析方法。
本文仅讨论其中的两个重要参数:粒度及粒度分布、药物载体的包封率以及相应的检测方法。
粒径及分布
纳米药物制备的关键是控制粒子的大小和获得较窄且均匀的粒度分布,减少粒子团聚现象,保证用药有效、安全和稳定。因此,纳米粒径及其分布是表征纳米药物的最重要的指标参数,也是纳米药物的研发和质量控制中的重要内容之一。
以下介绍了几种应用广泛、比较准确、实用的纳米粒度测量方法。
X射线小角散射法
X射线小角散射法(SAXS)是利用X射线小角散射效应测定纳米颗粒粒度分布的一种有效方法,其相关理论、实验技术和数据处理方法已臻成熟,现已制定了国际技术规范和国家标准。它一般可以测定颗粒尺度为1~300 nm 的超细颗粒的粒度分布,也可以测量无机、有机溶胶以及生物大分子粒度;但不适合于有微孔存在的颗粒以及不同材质组成的混合颗粒。
X射线散射法小角的原理是:当一束极细的X射线穿过纳米粉末层时,经过颗粒内电子的散射,就会在原入射X射线束周围的0~2小角区域内分散开来,其散射强度分布与颗粒的粒度分布相关。若假定试样中的粒度分布是连续的,可以用一种连续的分布函数来表达其粒度的分布。
光子相关光谱法
光子相关光谱法(Photon Correlation Spectroscopy, 简称PCS)又称为动态光散射法,是近年来用于纳米粉体粒度测试的新方法。光子相关光谱法是测量亚微米及纳米颗粒粒度的有效方法,其测量原理基于颗粒的布朗运动。悬浮液中的颗粒由于受到周围进行Brownian 运动的分子的不断撞击,不停地进行随机运动。在激光的照射下,在一定角度下,运动颗粒的散射光也将产生随机的波动。波动的频率与颗粒的大小有关,颗粒越小,波动涨落越快。因此,这种波动包含颗粒的粒径信息。
PCS相比于电镜法的最大优点是可获得精确的、统计的粒径分布,但对于固体,必须是将其制成分散度良好的悬浮液,因此对待测纳米粉体的分散是准确表征纳米粉体粒度的前提。
此外,表征分散体系稳定性的重要指标是Zeta电位,由于带电微粒吸引分散系中带相反电荷的粒子,离颗粒表面近的离子被强烈束缚着,而那些距离较远的离子形成一个松散的电子云,电子云的内外电位差称为Zeta电位。只有Zeta电位在±30 mV以外,体系才是稳定的,颗粒不容易团聚。
透射电子显微镜法(TEM法)
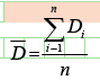
透射电子显微镜法是粒子粒径分析最常用的方法之一,透射电子显微镜可观察和表征纳米粒子的形貌和测定粒径大小。测定时,将纳米粒子制成悬浮液并滴在带碳支持膜的铜网上,待载液如乙醇挥发后,放入样品台。每种纳米粒子分别选有代表性的A、B和C三组纳米群拍摄高倍电镜像,每张照片中随机选取一定数量的(如50颗粒)纳米粒子测量粒径,按下列公式计算得出平均粒径。
原子力学显微镜法
纳米技术的诞生是以扫描隧道电子显微镜(Scanning tunneling microscopy,STM)和原子力显微镜(atomic force microscopy,AFM)的发明为先导的。近年来,原子力显微镜在生物医学领域越来越广泛,与光学显微镜相比,其优点在于分辨率大大提高,可以达到纳米级。与电镜相比,它可以在生理状态下成像,比电镜需要的真空环境方便了许多;样品制备时间短,且易操作。有人用原子力显微镜(AFM)作为主要表征手段观察液体纳米药物的颗粒大小及形貌特征,为液体纳米药物在生理状态下的研究提供实验依据。
X射线衍射线线宽法(谢乐法)
使用多晶X射线衍射仪测定纳米粒子的晶体结构和平均粒径大小,根据谢乐的微晶尺度计算公式,计算纳米粒子的平均粒径

式中,λ=0. 154 059nm,为X射线的波长(Cu靶),βHKL=?–?O,为衍射线半高峰强度处因晶粒度细化引起的宽化度,?,?O分别为实测半高峰宽和仪器宽化度(通过测量粒径>1μm标准物而得)。
在测定中选取4条低角度(2θ≤50)X射线衍射线计算纳米粒子的平均粒径。
其他方法
现有粒度分析的方法很多,同一样品用不同的方法得到的粒径的物理意义乃至粒径大小也有所不同;因此,应根据被测对象种类、测量准确度和测量精度的要求等选择合适的方法。目前,除以上介绍的几种外,还有其他一些方法如紫外-可见分光光度法、毛细管区带电泳法等。
药物载体的包封率
包封率是评价纳米微囊、微球及脂质体等剂型质量和工艺优劣的重要指标,中国药典2010年版(二部) 附录ⅪX E 微囊、微球及脂质体制剂指导原则中规定:若得到的是分散在液体介质中的微囊、微球、脂质体,应通过适当方法(如凝胶柱色谱法、离心法或透析法)进行分离后测定,即先用一定的方法把未包封的游离药物与微囊、微球或脂质体分离开并测定后,根据总投药量计算包封率。或分离后测定包封(脂质体)的药物量与磷脂的比例,计算药脂比。
分子排阻色谱法
又称凝胶色谱法,是利用脂质体与游离药物分子质量和粒径大小的差异进行分离,脂质体粒径较大先被洗脱,游离的药物粒径较小后被洗脱从而达到分离效果,常用的分离介质是葡聚糖凝胶和琼脂糖凝胶。基本方法是先将溶胀好的凝胶装入柱子中,用洗脱液冲洗柱子至平衡后,将脂质体上柱,洗脱。
微柱离心法
微柱离心法可快速、简便分离脂质体内外相药物,所需样品量小,且几乎不影响原来样品性质与状态的脂质体包封率测定,尤其适用于一些中间过程的检测,如药物释放过程、主动载药过程,其优点是在最初的离心中已除去增加脂质体体积的过量空白溶液,因此不经稀释即可重新得到脂质体,需注意的是,该法是建立于脂质体不被填充物物理滞留的假设之上,应事先检验该假设。
透析法
透析法是把药物放入一定截留分子量的透析袋中,再把透析袋置于比其体积大许多倍的透析介质中,游离药物顺浓度梯度从透析袋内渗透到透析袋外,而脂质体由于粒径较大而不能渗透到外部介质里,然后在不同的时间测定介质中的药物浓度,直至外部介质中的药物浓度不变,说明透析袋内外游离药物的浓度相同且达到平衡,此时的时间作为游离药物透析平衡时间,测出此时介质中的药物浓度计算游离药物的浓度,进而计算出包封率。
离心法
根据脂质体与游离药物比重不同所受到的离心力不同,从而沉降速度不同,达到分离的目的,用来测定包封率。用离心法测定包封率可分为低速离心、超速离心和超滤离心等。如果脂质体与游离药物的粒径大小无重叠,可以用超滤离心法分离, 超滤离心法很适用于分离水溶性药物。
离子交换色谱法
离子交换色谱法是根据游离药物与脂质体所带电荷的不同而分离。Amselem S等将阳离子交换树脂加入到所制备的脂质体中,室温振摇20 min,未包封的阿霉素带正电荷,结合到阳离子交换树脂上,脂质体带负电荷不与阳离子交换树脂结合,过滤混合的脂质体和阳离子交换树脂使两者分离,从而得到去除游离药物的脂质体。
NMR法
Zhang XM等建立了测定脂质体包封率的NMR法,在跨膜pH梯度的存在下,用pH敏感的质子化学漂移试剂做标记物,通过调节脂质体外相介质的pH,利用不同pH值下的游离药物和包封的药物的共振信号的位移不同,来识别脂质体包封和未包封的药物峰,测定脂质体的包封率。测定过程不需要物理分离,是一种测定脂质体包封率快捷简便的方法。
荧光淬灭反应法
荧光淬灭法指具有荧光的物质如钙黄绿素、羧基荧光素等水溶性荧光物质或者具有荧光的药物,在高浓度时发生自淬灭,在某一低浓度范围内,荧光强度又和浓度成正比。高浓度时包封于脂质体内水相中,然后高度稀释于分散介质中,这时包封在脂质体内水相中的荧光物质保持自淬灭无荧光产生,而未包封在脂质体外的水相中浓度降低荧光重现,加入破膜液后,脂质体的内水相中荧光物质释放,稀释到适当浓度发出荧光,通过荧光检测器测定荧光值,准确测定最初脂质体包封和未包封的荧光物质浓度计算得到包封率。此方法意不需要分离脂质体和游离药物,直接测定药物的包封率,快速、准确,避免了分离带来的误差。
电子自旋共振光谱法
电子自旋共振光谱法也被用于包封率的测定,当添加顺磁性试剂如铁氢化物时,外部标记物的电子自旋谱带会显著加宽;还可以利用包裹在脂质体内部的标记物与游离标记物间扩散系数的不同来测定包封率。
鱼精蛋白凝聚法
将一定量的脂质体和鱼精蛋白溶液快速混和,脂质体与鱼精蛋白产生凝聚,通过过滤或离心,分离上清液(或滤液)和凝聚物,测出上清液(或滤液)中的药物浓度为游离药物的浓度,聚集物中的药物浓度为包在脂质体中的药物浓度,计算包封率。
江苏省食品药品检验所 南京中医药大学
展源
何发
热点文章
-
【必看】1分钟看懂qPCR曲线图
2025-11-27
-
【小知识】实验室单位换算!
2025-12-22
-
【必看】生物安全实验室分类
2025-12-18
-
GB/T 18242-2025 弹性体/塑性体改性沥青防水卷材
2025-12-05
-
【收藏】实验室易制毒、易制爆的化学品
2025-12-16
-
【收藏】金黄色葡萄球菌检测!
2025-12-08
-
【必看】实验室标识
2025-11-25
-
独立百天,新生启航:Solstice Advanced Materials中国首秀,锚定先进计算、可持续发展、生命科学新航道
2026年1月末,距离从霍尼韦尔正式分拆独立,并在纳斯达克挂牌上市将满百日时,全新的特种材料公司 Solstice Advanced Materials在上海举办了其独立运营后的首次中国媒体见面会。
作者:张明
-
安捷伦在中国:加速本土创新与绿色发展的双重推进
-
洞察未来,共谋发展 “ 数·智·未来 ” 安捷伦未来实验室媒体圆桌会成功举办
-
食品检验理化常用国家标准与要点
-
水分测定方法开发研究&检测相关问题故障分析解决解读
-
药物常用的晶型表征方法









评论
加载更多