水华原位快速分析技术初探
水华原位快速分析技术初探
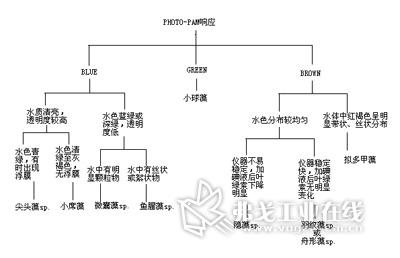
图1. 宁波市常见水华快速检索。
水华监测已经成为环境监测的一个重要环节。如何有效地对水华进行原位快速分析是各监测部门所面临的难题。本文应用PHYTO-PAM叶绿素荧光仪,通过多年原位监测数据结合实验室模拟结果,建立了一套水华原位分析技术,为水华监测的现场快速反应提供技术支持。
水华是一种水体中藻类异常快速增殖的自然现象,大量藻细胞受迫短时间内消亡时可能使水体腥臭难闻,溶解氧减少,大量鱼类死亡,严重的还会影响饮用水水质安全,危害周围居民的身体健康[1,2,3],此外,如微囊藻等蓝藻还可能会产生藻毒素。
鉴于现场应急监测的紧迫性,经常需要现场判断水体异色的成因,确定污染的程度、发展趋势及危害,以便及时有效地采取措施。水华的现场分析包括水华种类的确定(污染类型)、水华藻生物量/密度测定(污染程度)、水华消长趋势分析以及水源的安全性。
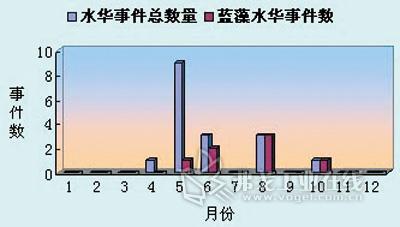
图2. 2006~2010年宁波市主要饮用水源地水华季节分布概况。
水华优势种确定
能引起水华现象的藻类有很多,常见的水华按优势种类可以分为15个基本类型[4]。以宁波地区为例,近年来常见的水华主要有蓝藻、绿藻、硅藻、甲藻、隐藻5门9种。
水华优势种有多种实验室确定方法,最常用的是显微镜观测法和PCR荧光定量分析法,但这两种方法耗时较长,且需要专业人员操作,不适合现场的快速分析需要。荷兰CytoBuoy浮游植物流式细胞仪可对大小在0.4~4 mm的浮游植物进行分析,但其价格较贵,目前为300万左右,且分析精度一般,特别对于球形藻的区分度较低,还需要进一步改进。
不过,不同优势藻种的水华的表观现象和荧光特性略有差异,与温度也存在着较大相关性。通过对这些信息进行系统分析整理可得到较为准确的初步判定结果,如图1所示。由于目前统计的水华个案数量较少,仅17次,所以其与温度的相关性只能作为参考,如图2。
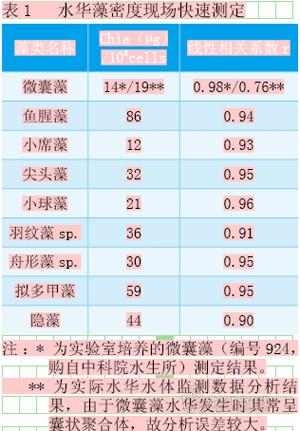
藻生物量/密度快速测定
水华生物量测定主要有镜检法、OD法(光密度法)、颗粒计数器法、荧光法以及流式细胞仪法等。由于显微镜属于不便移动的检测设备,故一般只适用于实验室分析。光密度法是利用同种藻的藻密度与分光光度计的吸光值在一定波长下成正比(不同藻略有差异,一般认为是680nm左右),但是对于有浊度的样品或是非纯种样品,分析结果可信度较低。颗粒计数器法与流式细胞仪的工作原理相似,在一定电压下让水通过一狭缝,其中的藻细胞逐个通过狭缝时进行计数,但颗粒计数器无法对非藻类颗粒物进行区分。荧光法也是较常用的浮游植物生物量测试方法之一,它根据不同生物量藻液中生物量与藻类发出的荧光值呈正相关计算得到。由于非藻类的颗粒物不产生荧光,故此方法测定精度较高,低浊度水样中的非藻类颗粒物不会对测定结果产生影响。
水华消长趋势分析
水华的消长受到温度、光照、流速、降水、营养盐浓度、捕食生物等因素影响。目前的研究多以单因子或少数几个偶联作用为主[4]。由于在原位研究过程中忽略了部分因子的作用,使得水华的预测模型成功率不高。
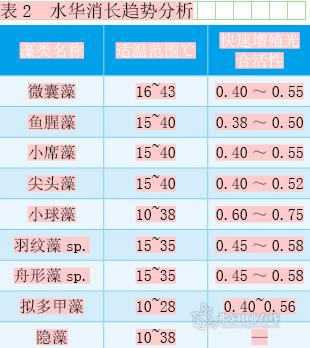
表2的适温范围为实验室单因子胁迫实验测得。结果表明,一般蓝藻的适温范围较高,在较高温度下其增殖可能性较大;拟多甲藻的适温范围较低,高温对其有很大杀伤作用;而小球藻和硅藻的适温范围较宽,一般温度对其活性影响不大。
因为叶绿素荧光可以估计光系统II的光化学电荷分离的效率,并且所有的电子都是通过光系统II泵出来,因此环境因子对整个电子传递步骤的任何影响可通过叶绿素荧光的变化反映[5,6]。藻类快速增殖时,其光合活性一般都处于较高水平[7]。但若单用即时的光合活性预测水华藻生物量,得到的发展趋势也是不科学的,因为即时的光合活性只代表当时藻群总体受环境胁迫情况,结论还应以环境胁迫总量维持相对稳定为前提,否则应根据环境胁迫总量的变化而对变化趋势的结论作出调整。
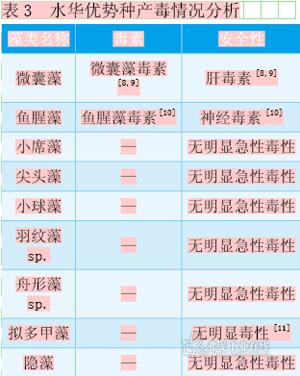
水源安全性判断
微囊藻能产生微囊藻毒素,为肝毒素,可诱发肝癌;鱼腥藻能产生鱼腥藻毒素,为神经毒素;其他藻不产生明显毒素。对于微囊藻或鱼腥藻水华,应时刻关注其毒素产生情况,饮用水经特殊处理后才能供应,必要时需采取停水措施。对于其他水华,因当其短期内大量死亡可能带来严重的生态后果,且此时的营养盐浓度已完全符合有毒藻华发生条件,所以应密切关注其密度和种群变化动态。
结语
使用荧光仪可对水华种类、水华藻生物量/密度、水华消长趋势以及水源的安全性进行现场快速分析,为管理部门的现场决策提供技术支持。为进一步完善结论,还应加强对水华水体的跟踪监测,并从源头上截污、控污,降低富营养程度,避免水华现象反复发生。
【参考文献】
[1] 陈飞勇, 刘凤丽, 金峰等.蓝藻的特征及其水华防治研究[J].人民长江,2008,2:69-70.
[2] 周云龙,于明.水华的发生、危害和防治[J].生物学通报,2004,6:14-17.
[3] 王扬才,陆开宏.蓝藻水华的危害及治理动态[J].水产学杂志, 2004,1:91-95
[4] 孔繁翔,高光.大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J].生态学报,2005,25(3):589-595
[5] 韩博平等.藻类光合作用机理与模型[M].北京:科学出版社,2003.12:130-131
[6] C.VAROTTO,Identification of of photosynthetic mutants Arabidopsis by automatic screening for altered effective quantum yield of photosystem 2[J].Photosynthetica, 2000,38(4):497-504.
[7] Wilhelm C, The biochemistry and physiology of ligh-tharvesting processes in chlorophyll b and chlorophyllc-containing algae[J]. Plant Physiology and Biochemistry.1990,28: 293-306.
[8] 傅晓钦,徐能斌,朱丽波等. 宁波市饮用水源地爆发蓝藻水华时微囊藻毒素的污染分析[J].中国环境监测,2008,6:80-84
[9] 燕晓雯,林晓. 微囊藻毒素危害研究进展[J]. 江苏预防医学,2008,4:84-85
[10] 李开源,丁明.云南程海蓝藻毒性研究[J]. 云南大学学报(自然科学版),1998,3:193-196
[11] 周广杰,况琪军,刘国祥等.三峡库区藻类水华调查及其毒理学研究[J].水生生物学报,2006,2:37-40
[12] 张力军,于洪存. 发光菌的急性毒性试验以及对废弃物毒性的评价[J]. 辽宁城乡环境科技,1999,5:25-28
宁波环境监测中心
展源
何发
相关文章
-

水华原位快速分析技术初探
2020-05-27
-
检测有机氯类农药,气相色谱法检测法
2021-01-12
-

环境监测技术问题及对策分析环境监测技术问题与完善对策
2021-09-07
-

2018环境监测与分析技术研讨会即将召开!
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

环境分析监测十年变化之前处理技术的变迁
2020-05-27
-

环境分析监测十年变化之分析与监测方向的调整
2020-05-27
-

环境样品中多种微量元素的快速检测
2020-05-27
-

岛津PESI原位离子化质谱技术在公安食品药品快速检测领域的技术探索
2021-04-08

加载更多