
美国药典(USP)拟定新通则<1469>NITROSAMINE IMPURITIES,用于对制药行业可能存在亚硝胺杂质进行风险评估和控制。该标准的目的是为控制亚硝胺杂质、消除或减少亚硝胺杂质在药物产品中的存在提供一种基于科学的方法。目前该通则已结束修订,预计今年下半年正式出版。
建议相关的原料药/制剂/辅料生厂商和供应商、合同制生产组织、药品检测和监管机构、QA/QC专家参考该通则。
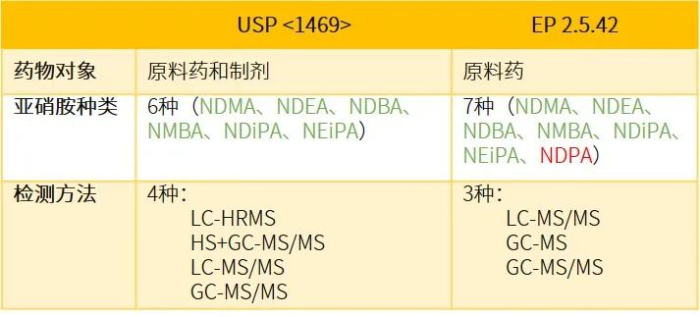
USP<1469>与FDA亚硝胺杂质指南基本一致,并且都主张采用基于风险的方法进行评估。USP<1469>确定的应在药品中检测的六种亚硝胺包括:N-亚硝基二甲胺(NDMA)、N-亚硝基二乙胺(NDEA)、N-亚硝基二异丙胺(NDIPA)、N-亚硝基乙基异丙胺(NEIPA)、N-亚硝基二丁胺(NDBA)和N-亚硝基甲基氨基丁酸(NMBA)。USP 清单与 FDA 清单的不同之处在于 FDA 清单中的化合物N-亚硝基甲基苯胺(NMPA)不在 USP 清单中。
与FDA一样,USP<1469>要求对潜在的亚硝胺进行风险评,在风险评估中应充分考虑可能引入亚硝胺的所有潜在来源,包括:
原料药工艺过程:原料、试剂、溶剂、加工助剂等
原料药降解物
溶剂降解物
来自于原料、溶剂(回收溶剂)、试剂、催化剂的杂质
来自于中间体和中间体生产带来的杂质
来自于水、辅料、加工助剂的杂质
制剂加工或包装材料引入或产生的杂质
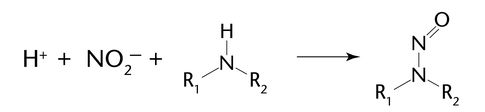
亚硝胺杂质的产生机理
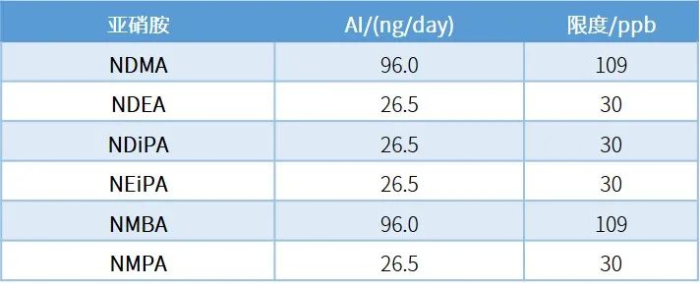
此外USP<1469>还遵循 FDA 指南,确保药物中的亚硝胺杂质每日摄入量不超过可接受摄入量(Acceptable Intake,简称AI)。FDA 规定 NDMA 和 NMBA 的AI为 96 ng/day,NDEA、NMPA、NIPEA 和 NDIPA 的AI为 26.5 ng/day。再结合药品活性成分的每日最大服用剂量(Maximum Daily Dose,简称MDD)确定亚硝胺杂质的在该药品中的(浓度)限度(AI/MDD)。
通则要求单个亚硝胺杂质不超过AI对应的限度,同时对检出浓度超过LOQ但不超过AI对应限度的多个杂质需咨询权威机构。笔者注:建议参考FDA的要求。
为了帮助供应商更好地检测亚硝胺杂质,USP<1469>提出了四种分析方法,生产商可以使用这些方法来检测其产品中是否存在亚硝胺。
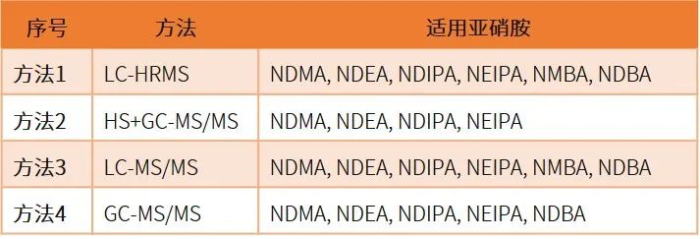
与EP 2.5.42仅限于原料药不同,USP <1469>适用于原料药以及制剂,同时要求生厂商对辅料、制剂生产工艺、包装系统做评估。下表简单列出二者的差异,供读者参考。
岛津可以为客户提供USP<1469>通则中的所有4种方法:

关于USP<1469>方法2,原文“Procedure 2: Quantitation of NDMA, NDEA, NDIPA, and NEIPA in selected sartans by GC–MS”,其实看接下来的条件,我们发现分析条件:“Injector: Headspace”,“Acquisition mode:multiple reaction mode (MRM)”,顶空进样+MRM质谱模式,其实是HS+GC-MS/MS。
应用案例1
岛津海外应用工程师参考USP<1469>方法2,对氯沙坦中的亚硝胺杂质进行了研究,在第二法适用的4种亚硝胺(NDMA、NDEA、NDiPA、NEiPA)进行了扩充,增加NDBA、NDPA和NMPrZ。设定MDD为880mg/day,计算代表性的亚硝胺杂质限度,如下表:
使用岛津HS-20和GC-MS/MS对方法进行研究,考察线性、准确度(回收率)、LOQ等参数,结果如下:
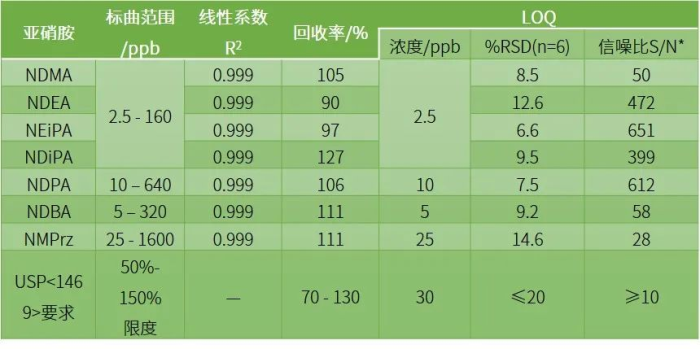
实验结果表明,岛津仪器性能超越了USP<1469>通则方法的要求,并且扩充了方法的适用范围,可以为制药企业风险评估提供精准的帮助!
应用案例2
参考<1469>方法3,使用岛津三重四极杆液质联用仪对奥美沙坦制剂中的六种亚硝胺(NDMA、NDEA、NDIPA、NDBA、NEIPA和NMBA)进行检测。
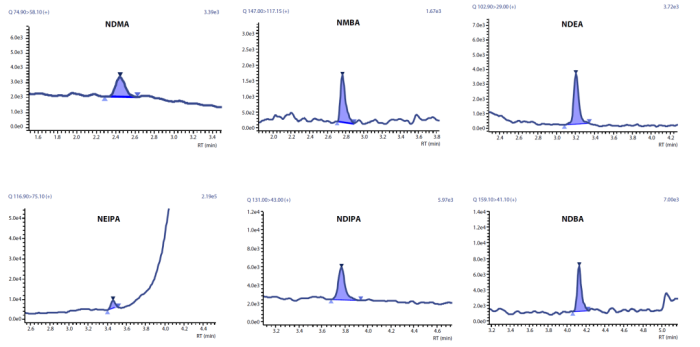
0.1ng/mL亚硝胺的MRM质量色谱图
数据展示:0.1 ng/mL 标准溶液的MRM色谱图如上图(该浓度是FDA要求的定量限值的 1/10)。在0.1 - 10 ng/mL浓度范围内的线性系数>0.99,该浓度范围内的精密度在80 - 120%,结果优异。
更多应用信息请联络岛津工作人员!