灼烧残渣小知识,含磷化合物残渣无法恒重?
案例思考
含磷化合物残渣无法恒重
实验室做某项目的炽灼残渣(马弗炉温度设置为700℃),第一天(马弗炉里面烧了8h)无法恒重。第二天继续放马弗炉里面烧(马弗炉里面烧了12h),也无法恒重。
分析化合物结构中含磷,烧后产生五氧化二磷,第二次实验尝试将马弗炉温度调至800℃继续烧。使劲做炽灼做了2天,无法恒重,初步计算下结果,残渣结果很大(约5%)远超过质量标准。
PS:化合物结构为:
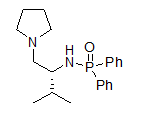
磷酸盐和氧化磷,硅元素(硅:熔点1410℃,沸点2355)都是不挥发的,炽灼结果可能生成盐、络合物等等。碳化过程中,C、N、S这些东西都能被氧化出去,唯独磷没有合适的途径除去,有可能会与硫酸形成复盐,导致炽灼不尽,无法恒重。
和行业界资深老师交流后,得知含磷原料药一般不测灼烧残渣。
结论:含磷化合物不适合用测灼烧残渣,如果一定要做质量标准需要研究充分后再定。
特殊样品
液体、不必或不能加硫酸的样品
参考GB/T 9741-2008上面的方法进行上述样品灼烧残渣的测定
取规定量的样品,置于已在650℃±50℃的恒重的、规定的坩埚或皿中,加入0.25mL硫酸,在水浴或电炉上加热(勿使沸腾),直至样品完全挥发或炭化。在电炉上继续加热至硫酸蒸汽逸尽,在650℃±50℃的高温炉中灼烧至恒重。
取规定量的样品,置于已在650℃±50℃的恒重的、规定的坩埚或皿中,缓慢加热,直至样品完全挥发或炭化。在650℃±50℃的高温炉中灼烧至恒重。
残渣小知识
坩埚的选择
瓷坩埚的涂层是硼砂、纯碱、杂玻璃等,主体是硅铝酸岩,主要成分是二氧化硅。
优点:耐高温可达 1200 ℃ ,内壁光滑,耐酸,价格低廉。
缺点:耐碱性差,灰化碱性食品(如水果、蔬菜、豆类等),坩埚内壁的釉质会部分溶解,多次使用后,往往难以得到恒量。温度骤变时,易炸裂破碎。
1.优点
铂的熔点高达1700℃,化学性质稳定,导热良好,耐碱,耐HF,吸湿性小。在空气中灼烧后不发生化学变化,也不吸收水分,大多数化学试剂对它无侵蚀作用,能耐氢氟酸和熔融的碱金属碳酸盐的腐蚀是铂有别于玻璃、瓷等的重要性质,因而常将其用于沉淀灼烧称重、氢氟酸熔样以及碳酸盐的熔融处理。铂坩埚适用于灼烧沉淀。铂在高温下有较小的挥发性,灼烧时间久后要加以校正。铂在900℃以下使用基本不挥发。
2.缺点
价格昂贵,约为黄金的9倍,要有专人保管,免丢失。 使用不当会腐蚀或发脆。
3.铂坩埚使用及注意事项
铂质地较软,即使含有少量铑铱的合金也较软(加入少量铑或铱是为了提高其机械强度),所以拿取铂器皿时勿太用力,以免其变形。在脱熔块时,不能用玻璃棒等尖锐物体从铂器皿中刮取,以免损伤内壁;也不能将热的铂器皿骤然放入冷水中,以免发生裂纹。已变形的铂坩埚或器皿可用其形状相吻合的水模进行校正(但已变脆的碳化铂部分要均匀用力矫正)。
铂器皿在加热时,不能与其它任何金属接触,因为在高温下铂易与其它金属生成合金,所以,铂坩埚必须放在铂三角架上或陶瓷、粘土、石英等材料的支持物上灼烧,也可放在垫有石棉板的电热板或电炉上加热,但不能直接与铁板或电炉丝接触。所用的坩埚钳子应该包有铂头,镍或不锈钢的钳子只能在低温时方可使用。
4.铂坩埚不能测哪些物质
下列的物质不能直接侵蚀或与其它物质共存下侵蚀铂,在使用铂器皿时应避免与这些物质接触:
a.易被还原的金属、非金属及其化合物,如银、汞、铅、铋、锑、锡和铜的盐类在高温下易被还原成金属,可与铂形成低熔点合金;硫化物和砷、磷的化合物可被滤纸、有机物或还原性气体还原,生成脆性磷化铂及硫化铂。
b.固体碱金属的氧化物和氢氧化物、氧化钡、碱金属的硝酸盐、亚硝酸盐和氰化物等,在加热或熔融时对铂有腐蚀性。碳酸钠、碳酸钾和硼酸钠可以在铂器皿中熔融,但碳酸锂不能。
c.卤素及可能产生卤素的混合溶液,如王水、溴水、盐酸与氧化剂(高锰酸钾、铬酸盐和二氧化锰等)的混合物、三氯化铁能与铂发生作用。
d.碳在高温时,能与铂作用形成碳化铂。铂器皿若放在碳硅棒电炉内,因有必要的通气装置;若用火焰加热时,只能用不发光的氧化焰,不能与带烟或发黄光的还原火焰接触,亦不准接触蓝色火焰,以免形成碳化铂而变脆。在铂器皿中灰化滤纸时,不可使滤纸着火。
e.成分和性质不明的物质不能在铂器皿中加热或处理。
f.铂器皿应保持内外清洁和光亮。经长久灼烧后,由于结晶关系,外表可能变灰,必须及时注意清洁,否则日久后杂质会深入内部而使铂器皿变脆而破坏。
5.铂器皿的清洗方法
若铂器皿有了斑点,可先用盐酸或硝酸单独处理。如果无效,可用焦硫酸钾于铂器皿中在较低温度熔融5~10 min,把熔融物倒掉后,再将铂器皿在盐酸溶液中浸煮。若仍无效,可再试用碳酸钠熔融处理,也可用潮湿的细砂(通过100目筛即0.14 mm筛孔)或细金相砂(0#)纸轻轻摩擦处理。
残渣小知识
其他元素残渣测定
含卤族元素和碱金属的要用铂坩埚.碱金属(alkali metal)指的是元素周期表ⅠA族元素中所有的金属元素,目前共计锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)六种,前五种存在于自然界,钫只能由核反应产生。碱金属是金属性很强的元素,其单质也是典型的金属,表现出较强的导电、导热性。碱金属的单质反应活性高,在自然状态下只以盐类存在,钾、钠是海洋中的常量元素,在生物体中也有重要作用;其余的则属于轻稀有金属元素,在地壳中的含量十分稀少。
铂:熔点1773℃
钠:沸点881.4℃
钾:沸点765.5℃
硫酸钾:沸点1689℃
硫酸钠:沸点1404℃
铝:熔点660℃。沸点2327℃
硫酸铝:770℃分解为氧化铝和三氧化硫。
氧化铝:熔点2054℃ 沸点2980℃
建议:如果药品价格不高的话,详细进行一下方法的研究,严格操作,制订一个范围(一般较宽),根据钠的计算量与硫酸灰分的折算量加上自己的实测量,制订一个宽泛的范围15-22%,最后陈述不订入质量标准的理由(误差较多没有实际控制的意义等,这句话的前提是充分试验的基础上,而不是理论分析)。
分析与GMP
展源
何发
相关文章
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-
.jpg?x-oss-process=image/resize,m_pad,w_80,h_60,color_eeeeee)
研究证实氢氦化合物不会在高压下生成
2020-05-27
-

气相色谱法测定工业用异戊烯中含氧化合物
2020-09-27
-

金属化合物的测定
2021-05-25
-

科普:食物富含镁 预防痴呆症
2023-03-27
-

测定环氧化合物环氧当量
2020-05-27
-

常见化合物的pKa
2025-03-05
-
岛津Deans Switch系统在汽油中苯胺及含氧化合物分析中的应用
2020-05-27
-
环氧化合物环氧当量的测定
2020-05-27

加载更多