这些蛋白质互作实验方法,你都了解吗?
蛋白质-蛋白质相互作用(PPI)对解析生命活动过程与疾病发生发展过程至关重要。随着时代发展,虽然大规模、高通量的生物学研究手段大大促进了蛋白质相互作用的预测,但这种预测还需要进一步利用体外和体内系统进行验证。分析蛋白质互作的方法多种多样,跟小析姐一起来看看吧。
免疫共沉淀 Co-IP
免疫沉淀 (IP) 、免疫共沉淀 (Co-IP) 和pull-down 都是常用的从复杂的混合样品中获取目标分子,以进行下一步分析的方法,如检测蛋白质能否相互作用。在此类实验中,被研究的蛋白质称为“诱饵”蛋白,“诱饵”蛋白的互作蛋白称为“猎物”蛋白。“诱饵”蛋白与“猎物”蛋白结合后,利用靶蛋白—抗体—Protein A/G—磁珠/琼脂糖珠的结合方式获取复合物,再通过SDS-PAGE、Western blot 或质谱等方法进一步对复合物中的靶蛋白进行分析。
免疫共沉淀方法简单,是识别感兴趣蛋白质的相互作用、深入了解其结构和功能的初步实验方法。但是它也有相应的局限性,比如很难验证两种蛋白质是否直接发生相互作用、不能得到这种相互作用亲和力等定量信息等。因此需要在相互作用分析与筛选后,使用其他方法验证更详细的相互作用信息。
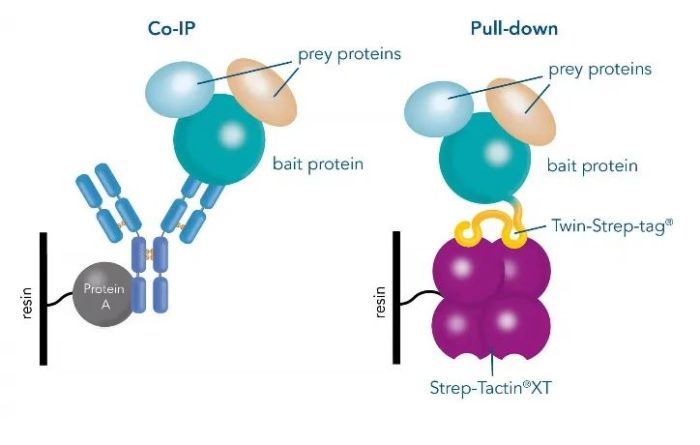
图1:使用抗体进行 Co-IP 与使用 Strep-Tactin®XT 进行pull-down
融合蛋白沉降 pull-down
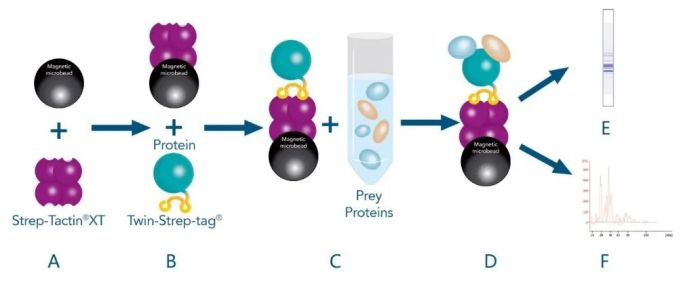
表面等离子共振SPR
SPR的原理是在芯片表面固定一层生物分子识别膜,然后将待测样品流过芯片表面,若样品中有能够与芯片表面的生物分子识别膜相互作用的分子,会引起金膜表面折射率变化,最终导致SPR角变化,通过监测SPR的角度变化,获得被分析物的浓度、亲和力、动力学常数和特异性等。
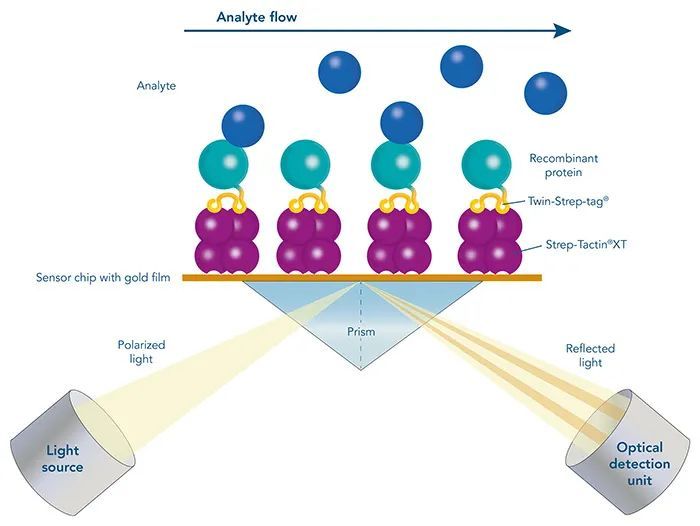
图三中所示的基于Strep-tag®系统方法,采用是间接的捕获方式来分析目的蛋白,解决配体稳定性差、纯度低、再生困难的同时,可进行定向、高亲和力的配体固定,实现长解离时间和慢解离速率的测量,最小化非特异性结合。
生物膜干涉 BLI
生物膜干涉技术(Bio-Layer Interferometry, BLI), 是一种无标记(Label-free)光学生物传感技术,用于实时监测分析生物分子相互作用(例如抗原-抗体相互作用),并对其结合强度和动力学进行量化分析。与SPR技术不同的是, BLI技术中不使用金属芯片,而是利用生物传感器。将配体偶联在传感器的末端,浸入样品中来捕获分析物。
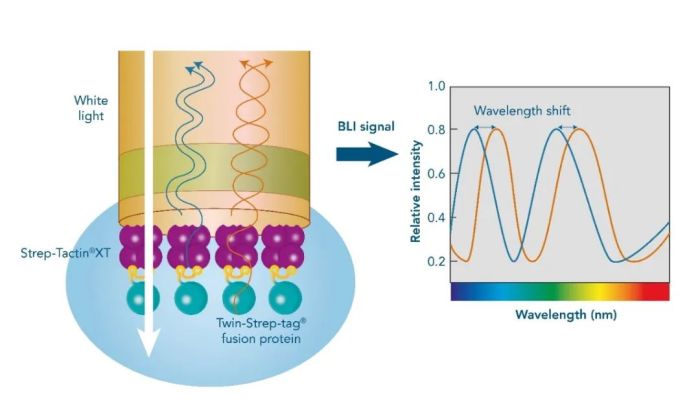
当光束射出后,对来自生物传感器末端表面的反射光进行测量,如果配体与分析物相互作用,则末端表面的膜层比仅有配体(未结合分析物)的膜层更厚,反射光波长也不同,两种反射光谱之间的波长形成一束干涉光谱。BLI 仪器通过测量来自配体,或配体-分析物的复合物的干涉光谱位移值,实现结合强度和动力学的实时监测。
邻近蛋白标记BioID
邻近蛋白标记(biotin identification,BioID,生物素标记) 方法可以鉴定诱饵蛋白附近的蛋白质。通过将生物素连接酶(BirA)与诱饵蛋白融合表达,加入适量生物素,融合蛋白的相互作用/附近环境中的蛋白质会被生物素化。之后通过链霉亲和素或Strep-Tactin®进行亲和纯化,将被生物素化的蛋白质从细胞裂解液中富集出来,产物做质谱鉴定。
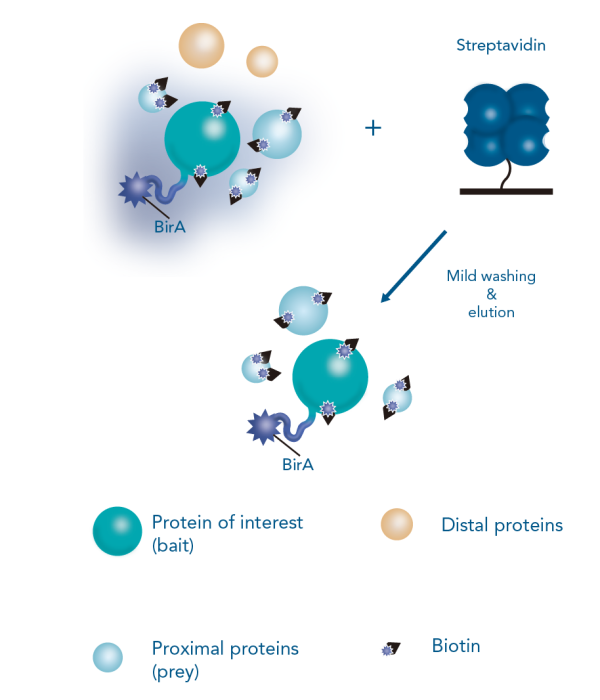
图5:BioID的原理
以上即为几种常用的蛋白质互作研究方法,另外还有很多其他相关技术可以探索。
展源
何发
相关文章
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

蛋白质相互作用研究
2020-05-27
-

蛋白质鉴定更加准确
2020-05-27
-
蛋白质检测的捷径
2020-05-27
-
使蛋白质检测更容易
2020-05-27
-
CEM掀起蛋白质测定技术革命
2020-05-27
-

流变学表征蛋白质药物
2020-05-27
-

简述蛋白质组鉴定技术
2020-05-27
-

蛋白质组鉴定技术简述
2020-05-27

加载更多