液相色谱柱,质谱(LCMS)方法开发指南
反相色谱流动相的选择
一般来说,反相 LC 的流动相包括水和作为改性剂的乙腈或甲醇。不太常用的改性剂还有四氢呋喃(THF)和异丙醇。我们建议一定要使用色谱级以上的溶剂和改性剂。对于 UHPLC,建议只使用 LC/MS 级以上的溶剂。选择性差异和样品的保留都会因流动相不同而明显改变。样品溶解度也很可能不同,需要使用特殊的溶剂或多种溶剂。
在反相色谱中,流动相中水相的 pH 和离子强度在开发对条件微小变化不敏感的耐用方法中非常重要。对于离子型化合物,典型样品的保留随 pH 改变而明显变化。在这类反相系统中,控制 pH 对于保留和选择性的稳定非常重要。通常在 pH 2 到 4 条件下,保留时间对 pH 的微小改变稳定性最高,因此建议将这一 pH 范围作为大多数样品方法开发的起始 pH,包括碱性化合物和一般的弱酸。考虑到重现性,所用的 pH 应高于或低于待分离溶质 pKa 或 pKb 上下一个 pH 单位。
您可能不清楚分析物的 pKa,因此,测试一种以上流动相 pH 可提供最好结果。大多数反相柱都可以在 pH 2-8条件下使用,为您的分离选择最佳流动相 pH 提供了较宽的范围。请注意,测定流动相 pH 时,要在水相与有机改性剂混合之前在水相中进行测定,以确保得到准确而可重复的结果。
流动相操作
当您开始启用刚从包装盒中取出的新柱时,只能使用与柱内装运溶剂兼容的溶剂。为防止缓冲液在色谱柱内沉淀,反相操作时不能将缓冲液泵入用 100% 有机溶剂装运的色谱柱。我们的建议是,先用不含缓冲液的流动相平衡色谱柱,然后再用含缓冲液的流动相平衡。氰基和氨基柱都既可以使用正相溶剂,也可以使用反相溶剂,因此,在平衡前需要检查您的溶剂是否与装运溶剂混溶。如果想把一根正相柱变为反相柱,要先用彼此混溶的溶剂冲洗,如异丙醇。然后再用您的流动相平衡。溶剂的混溶性图表见有用的参考资料一章。
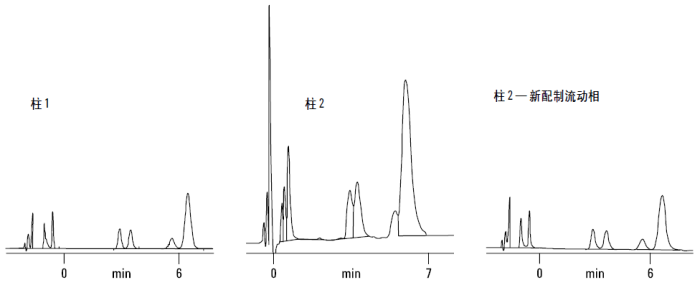
开始在一根较旧的色谱柱(柱 1)上进行分析,性能尚可。但色谱操作者改用一根新柱(柱 2)进行分离,关键组分的分离度明显变差,于是便认为新柱“较差”。当色谱操作者用新配制的流动相缓冲液进行分析时,分离度又恢复了正常,见右侧的色谱图。在这本例中,问题就出在溶剂瓶中“坏了”的 TFA 或磷酸上。这些溶剂使用了一段时间后,已产生了变化或被污染。
使用与流动相相同的溶剂进行样品配置非常重要。当进样溶剂比流动相强时,可能出现峰变宽或分裂。
流动相混合
有时,流动相会因为实验室中的混合方式而不同。例如,如果要配制甲醇/水=50/50 的混合溶剂,应先量取各自的体积,分别置于洁净的玻璃容器中,然后再将其混合,因为甲醇和水混合溶剂的总体积大于各自体积之和。如果在同一个容器中混合,混合溶剂的总体积就会不同。因此,这两份以不同方式配制的流动相组成存在差异。
流动相脱气
流动相脱气也很重要。在流路中,溶解在溶剂中的气体可能逸出,形成气泡,并有可能干扰泵或检测器的性能。幸运的是,现在大多数液相色谱系统都配备在线脱气机。
用流动相改性剂控制 pH
流动相 pH 对色谱分离的影响有多种方式。根据您所分析的化合物,pH 可能影响选择性、峰形和保留。如果是非极性较强或中性的化合物,pH 对分离度和保留的影响一般不明显。
下图显示了一个 pH 是如何影响分离度的简单实例。左侧,是一个分别在 pH 3 和 7 条件下分离的非极性样品的例子。请注意,两张色谱图没有区别。
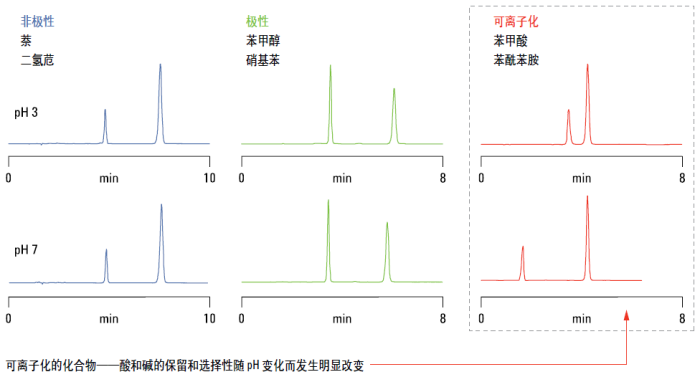
可以看出,中间的极性化合物在 C18 柱上保留较弱。请注意,pH 对两个化合物的保留时间和峰形几乎没有影响。
如果是可离子化的化合物,如酸或碱,可以看出保留因子和选择性随 pH 改变变化非常明显。请看右侧中苯甲酸和苯酰苯胺的例子,保留因子随 pH 改变而变化。苯酰苯胺是中性化合物,保留几乎不变,而苯甲酸的保留在 pH 从 3 变为 7 时变化非常明显。在 pH 7 条件下,大大高于苯甲酸的 pKa,苯甲酸是以阴离子的形式存在。这种偏离子形态与水相流动相的亲和性较好,比 pH 3 时从色谱柱中洗脱更快,在 pH 3 条件下,其主要是以离子抑制形式存在。
在开发可离子化分析物的分析方法时,重要的是要清楚非离子化形态的分析物比离子化形态的分析物保留更好。
如果是酸性分析物,应选择低 pH 缓冲液流动相,以防止分析物离子化。了解分析物的 pKa,才能够有效地选择流动相 pH。缓冲范围应在其缓冲液离子 pK 值的 +/-1 pH 单位,使流动相的优化具有一定的灵活性。例如,醋酸盐的 pKa 为 4.8,缓冲范围从 pH 3.8-5.8。甲酸盐的酸性较大,缓冲范围为 pH 2.8-4.8。如果您的酸性分析物在低 pH 下不能发生离子化,还可以选择其它缓冲液。
对于碱性化合物而言,在高 pH 条件下才能得到其非离子化形态,但这对色谱柱不利。但许多碱性化合物在低 pH 条件下的保留就已经足够了。因此,虽然非离子化形态能得到更高的保留,但这对与所有的碱性化合物并不是实用和必要的。
另一个影响酸性和碱性化合物保留的问题是在中性 pH 条件下硅胶表面的硅醇基可能发生离子化。通常,这些硅醇基都发生去质子化,带负电荷。从而使带正电荷的碱性离子保留更强。这会导致离子交换相互作用,一种次级相互作用。由于与反相柱之间发生了相互作用而不是分配,导致峰展宽或峰拖尾。这种情况在低pH 条件下不会发生,这也是反相色谱中酸性流动相更适合分离离子型化合物的另一个原因。
缓冲液选择要点:
• 成功的 HPLC 分离不必完全抑制离子化——通常,在流动相缓冲容量足够的情况下,90% 的抑制即可
• 流动相的缓冲容量与配制的摩尔浓度,以及洗脱液的 pH 与缓冲离子 pK 的接近程度有关
• 通常在高于或低于缓冲离子 pK 1 个 pH 单位内,可以起到缓冲效果。
• 色谱操作者也可以选择非缓冲的流动相进行 pH 调节。这对于酸性分析物而言也不是不常用的,用单一的酸溶液进行色谱分离,酸的浓度应足以使 pH 比需要值低得多
• 对于碱性物质的分离,选择是比较有限的。TEA(三乙胺)不能完全溶于水,而且 pK (11) 很高,氨本身可以完全溶于水,但对大多数色谱柱来说 pK 值过高
UV 检测器常用的缓冲液
缓冲液的选择对检测方式有很大影响。对于使用 UV 检测器的色谱操作者来说,在目标波长下缓冲液应完全透光。缓冲液的 UV 截止波长最好低于 220 nm。许多常用的缓冲液都符合 UV 透光率的要求,尤其是色谱级或以上的缓冲液。例如,磷酸及其盐类具有良好的低 UV 透光率,和乙腈一起,成为许多方法开发工作者的首选。对碱的分离,可以选择 TEA-磷酸盐。磷酸盐在有机相比例高的溶剂中溶解度较低,针对这一缺陷,建议磷酸盐缓冲液与有机溶剂混合时,有机相不要超过 70%。所幸这些需要离子化控制的化合物通常极性都较强,不需要用高比例有机溶剂对其进行洗脱,甚至在其离子抑制状态。醋酸盐正如甲酸盐和 TEA 一样,在 240 nm 以下波长都有 UV 背景吸收,很难在 210 nm 以下达到有效使用浓度。由于方法开发工作者都依赖于 UV 检测,通常是从低 UV 波长开始获取 2D 通道和 3D 光谱图, 所以 ACN/磷酸盐组合可以满足方法开发的许多需要。
LC/MS 的考虑因素
当使用质谱检测器,LC/MS 离子源时,极其重要的一点是流动相中不能含非挥发性物质,有时甚至样品中也不能有,这样做是因为某些物质会在离子源中变干,可以防止流动相雾化时污染离子源。例如,溶剂前沿中有一定量样品基质中的无机盐,可能进入离子源。由于用 LC/UV 进行的方法开发可能以后还需要应用于 LC/MS,所以许多工作者不再使用磷酸、磷酸盐、不挥发的反离子,以及在离子源中可造成离子抑制的挥发性改性剂(TFA 和 TEA 就是最常见的例子)。
因此,如今的趋势是使用甲酸盐和醋酸盐,及其挥发性铵盐,成为主要的离子改性剂。虽然它们能完全溶解于有机溶剂,具有挥发性和高色谱级或质谱级纯度,但却不能在低波长下使用光学检测器(UV 或二极管阵列 UV)。改性剂必须加入水相和有机相中,有机相中改性剂的浓度略低(通常为水相中浓度的 85%),因为有机溶剂的吸收性质不同。另外,ELSD(蒸发光散射检测器)也需要完全挥发的流动相,可以代替 UV和/或 RID(示差折光检测器)进行许多分析,不再使用常用的前-MS 改性剂。
有关 pH 的几点注意事项:
当混合醋酸三乙胺或磷酸三乙胺时,应先加入磷酸盐或醋酸盐,然后再加入三乙胺,因为纯三乙胺可能不溶于水。
混合缓冲液的良好习惯:
1. 使用正常工作的 pH 计。按照目标 pH 值校正 pH 计。用 pH 计对 pH 进行可靠的测量非常重要。
2. 确保试剂尽可能新鲜。
3. 先把固体溶解在非常接近终体积的液体中。调节 pH 到目标值后,再添加液体使溶液达到目标体积。
4. pH 调节应在加入有机溶剂之前的水相中进行,加入有机溶剂后再测 pH 不可靠。
5. 缓冲液配制完成后,在 HPLC 系统上使用之前要进行过滤,去除水或盐中可能存在的颗粒。大多数HPLC 应用都使用 0.45 μm 滤膜;UHPLC 则使用 0.22 μm 滤膜。
某些盐,如醋酸铵和甲酸铵,吸湿性较强,如果将其长期放在试剂架上,开瓶并使用较长时间后,将吸收水分。所以,在方法开始时最好实验确定这些盐的不同摩尔浓度,确保方法对这类不可避免的波动具有足够的耐受性。
质谱学堂
展源
何发
相关文章
-

选对色谱柱,快速开发方法
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

怎样校正pH计(酸度计)?
2022-01-20
-

质谱检测法与蛋白质分析
2020-05-27
-

LCMS/MS方法检测动物组织中β-兴奋剂类药物
2020-05-27
-

一文掌握GC-MS质谱分析方法
2023-12-28
-

临床质谱——前处理方法汇总
2023-10-27
-

质谱分析技术原理与方法简介
2021-03-02
-

一文了解质谱定性与定量分析方法
2024-05-21

加载更多