ELISA 从原理到操作步骤全套详解
ELISA的原理,这一块相信小伙伴们都是非常熟悉的了,是以免疫学反应为基础,将抗原、抗体的特异性反应与酶对底物的高效催化作用相结合起来的一种敏感性很高的试验技术。
由于抗原、抗体的反应在一种固相载体──聚苯乙烯微量滴定板的孔(当然就是我们熟知的96孔板啦)中进行,每加入一种试剂孵育后,可通过洗涤除去多余的游离反应物,从而保证试验结果的特异性与稳定性。
在实际应用中,通过不同的设计,具体的方法步骤可有多种。即:用于检测抗体的间接法、用于检测抗原的双抗体夹心法以及用于检测小分子抗原或半抗原的抗原竞争法等等。
1
直接法原理
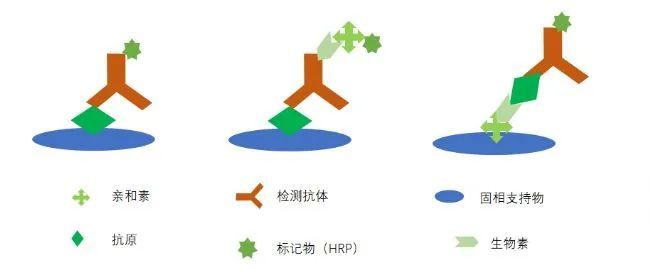
直接法是利用包被抗原,检测抗体或者进行重组蛋白的活性验证,利用蛋白与板材(即微孔板底)通过疏水键、流水/离子键的被动吸附,通过引入其它活性基团如氨基和碳基的共价结合,以及通过表面改性后的亲水键结合等等,当然也有利用亲和素预包被的板材,通过亲和素与生物素的共价结合及亲和素有四个残基理论可结合个生物素的特性,使结合的蛋白更多,灵敏度进一步提高,目前只是该方法的成本会升高。
直接法相对来说灵敏度和特异性较其他方法低,目前使用较少,通常用于重组蛋白或重组抗体的结合活性验证。而使用亲和素包被的板材主要原因在于大分子蛋白质较小分子蛋白质通常含有更多的疏水基团,故更易吸附到固相载体表面。蛋白质与聚苯乙烯固相载体是通过物理吸附结合的,靠的是蛋白质分子结构上的疏水基团与固相载体表面的疏水基团间的作用,当然好的板材也是成功的一半,聚苯乙烯具有较强的吸附蛋白质的性能。各方面表现较为均衡,是ELISA 反应中最常用的固相载体。小分子蛋白由于吸附性较差,固使用这样间接包被的形式才能起到理想的固定形式。
2
间接法原理
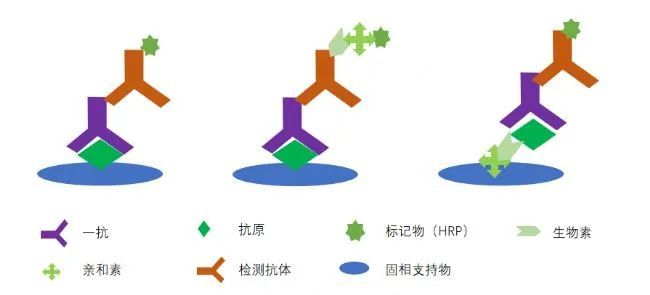
间接法相对直接法,灵敏度进一步提升,利用一抗与抗原的特异结合,再加入通用二抗(即检测抗体),如一抗使用的抗某蛋白的鼠抗,二抗可使用鼠/兔等抗该类型抗体(IgG)的抗体,利用抗体的特异性识别,加之显色用的二抗非直接与抗原结合,所以称之为间接检测,该方法一般用于抗体的检测,如重组抗体,或疫苗效价的检测,咱们打疫苗的目的就是产生中和抗体嘛,该方法在IVD企业使用较多。
3
夹心法原理
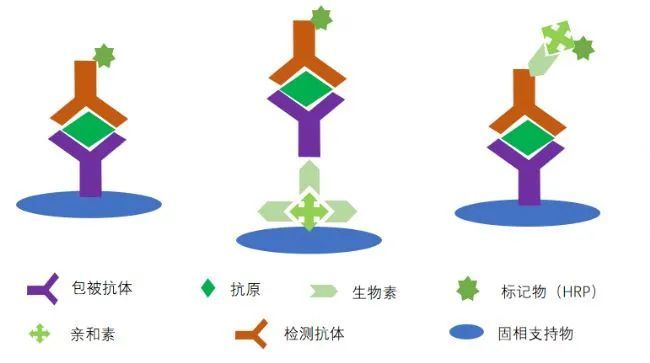
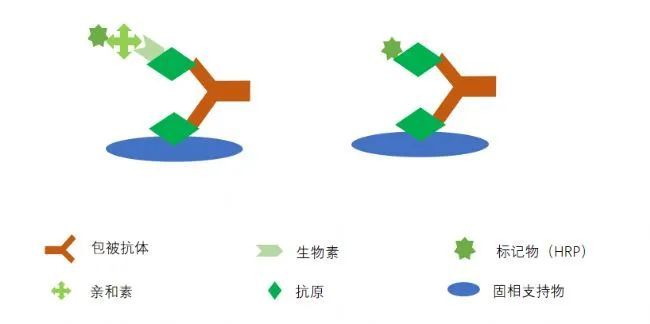
夹心法使用的是两个抗体夹抗原或者两个抗原夹抗体的方法,这种复合物被称之为三明治夹心结构,利用一对配对完全的抗体,可以特异性检测抗原,当然主要针对的是具有至少2个以上抗原表位的抗原,毕竟有两个抗体来结合嘛,抗体的配对可是门技术活,很多公司可以生产抗体,但是配对却很少做,主要原因在于筛选的难度,可能开发的几十株针对同一抗原的抗体,都很难有一对合适的可以配对,原因是多方面的,有抗原的表位、构象等原因,也有抗体效价的原因,当然还有筛选成本的原因,所以每一个ELISA试剂盒都是经过多次和长期的验证得来的哦!且用且珍惜!
那么双抗原夹抗体也就好理解了,是两个抗原共同结合一个抗体,也是用于抗体的检测啦!IVD最爱!
4
竞争法原理
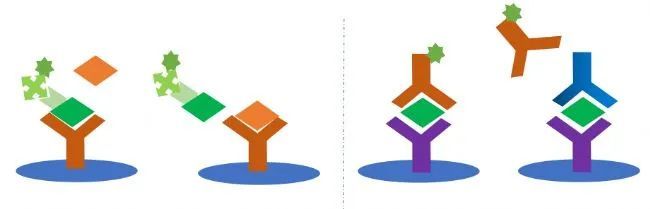
竞争法的使用相对来说就窄一点了,其原理是利用抗原抗体结合的可逆性(晶格学说),但在合适浓度时又可达到结合和解离的稳定期,那么亲和力更强的抗体自然就能更有效的结合抗原了。一般结合的解离使用最多的就是SPR和BLI技术了,可以高精度或高通量的测抗原/抗体、受体/配体的亲和力。
利用已知的抗原进行标记(抗原A),作为对照,实验组加入样本(抗原B)及标记抗原,与对照组相比,显色低,则该抗原A与抗原B竞争结合抗体,这种方法一般用于抗原材料中的干扰物质不易除去,或不易得到足够的纯化抗原。
包被抗体进行竞争法呢,一般用于ADA,竞争、非竞争抗抗体鉴定/筛选,抗抗体的竞争筛选是最有效的免疫原性检测手段之一。
5
操作步骤
说了这么多,原理小伙伴们应该都非常清楚了,那么如何去做呢?Absin为大家整理了详细的清单!强烈建议收藏!
6
样本问题
细胞培养上清:颗粒物应通过离心去除;立刻检测样本。样本收集后若不及时检测,建议按一次使用量分装,冻存于-20°C冰箱内,避免反复冻融。样本可能需要用稀释剂稀释(因为细胞培养用的BSA会影响实验结果,稀释后影响减少)。
血清:使用血清分离管收集样本,样品室温放置 30分钟。离心 15分钟,转速为1000 g。立即取出血清,并立即检测。样本收集后若不及时检测,建议按一次使用量分装,冻存于≤-20°C冰箱内,避免反复冻融。样本可能需要用稀释剂稀释(因为血清会影响实验结果,稀释后影响减少)。
血浆:使用 EDTA、肝素或柠檬酸作为抗凝血剂收集血浆,在收集后30分钟内离心 15 分钟,转速为1000 g,并立即检测。样本收集后若不及时检测,建议按一次使用量分装,冻存于≤-20°C冰箱内,避免反复冻融。样本可能需要用稀释剂稀释(因为血清会影响实验结果,稀释后影响减少)。
7
检测前准备工作
使用前所有试剂和样本需放置于室温,静置 15分钟。建议所有的实验样本和标准品做复孔检测。
洗涤液:从冰箱中取出的浓缩洗涤液可能有结晶,属于正常现象;放置室温,轻摇混匀,待结晶完全溶解后再配制洗涤液。依据所需用量计算浓缩洗涤液使用量,可将浓缩洗涤液用蒸馏水或去离子水稀释配置成工作浓度的洗涤液。未用完的放4°C。
显色剂:按当次试验所需要用量将显色剂A 和显色剂B 等体积混合,避光;在使用前15 分钟准备,现配现用;每孔需100 μL。
稀释用缓冲液:依据所需用量计算浓缩稀释剂使用量,可将浓缩稀释剂用蒸馏水或去离子水稀释配置成工作浓度的稀释剂。
SA-HRP:如提供的为浓缩 SA-HRP ,则需使用稀释用缓冲液(1×)稀释配置成工作浓度的1×SA-HRP,每孔需100 μL。检测抗体:将干粉离心至管底,检测抗体的重溶体积请参考瓶身标签,用稀释用缓冲液重悬至相应体积。(未用完的检测抗体溶液可保存于4°C冰箱。)
标准品:冻干标准品用稀释用缓冲液重溶,重溶体积请参考瓶身标签,按说明书制备标曲所用的稀释方式配置。
8
实验操作步骤
加样:加一定稀释的待检样品100 μL于上述已包被之反应孔中,置37℃孵育1小时。然后洗涤。(同时做空白孔,阴性对照孔及阳性对照孔)。
加酶标抗体:于各反应孔中,加入新鲜稀释的酶标抗体(按照说明书进行稀释)100 μL。37℃孵育0.5~1小时,洗涤3次。
加底物液显色:于各反应孔中加入临时配制的TMB底物溶液100 μL,37℃10~30分钟。
※ 加入终止液后30 分钟内,使用酶标仪测量450nm 的吸光度值,设定540nm 或 570nm 作为校正波长。如果没有使用双波长校正,结果准确度可能会受影响;
※ 计算结果:将每个标准品和样品的校正吸光度值(OD450-OD540/OD570)、复孔读数取平均值,然后减去平均零标准品OD 值。使用计算机软件作四参数逻辑(4-PL)曲线拟合创建标准曲线。另一种方法是,可以通过绘制标准品浓度做对数与相应OD 值对数生成曲线,并通过回归分析确定最佳拟合线。这个过程可生成一个足够使用但不太精确的数据拟合。
9
注意事项
1)正式试验时,应分别以阳性对照与阴性对照控制试验条件,待检样品应作一式二份,以保证实验结果的准确性。有时本底较高,说明有非特异性反应,可采用羊血清、兔血清或BSA等封闭。
2)实验材料的保存比较重要,一般需要注意的点如下:
※ ELISA试剂盒一般是4℃保存,如果有溶解后的标准品次日需要使用,则需要-20℃,防止降解导致结果不准;
※ 未使用的标准品与未用完的试剂盒一起保存,一般试剂盒拆分后建议一周内使用,由于湿度等影响,长期放置易引起产品的不稳定;
※ 对于洗涤,常规建议机洗,有些较为老款的洗板机由于时间较久,可能加液冲力较大或有固定的洗涤液,可能会导致结果异常,需慎重选择;
※ ELISA试剂盒正式实验前,建议先进行预实验,避免出现浓度超出检测限导致的结果无法使用的情况;
※ 各家试剂盒可能略有差异,使用前建议详细阅读说明书。
Super Lab
展源
何发
相关文章
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

ELISA试剂盒操作问题集锦,你不会的都在这里了
2021-12-02
-

Western Blot、ELISA、免疫荧光与免疫组化技术
2020-05-27
-

红外光谱分析,你了解多少?
2021-01-11
-

HPLC检测器,你了解吗?
2024-03-06
-

三聚氰胺,你还要害多少人
2020-05-27
-

超净工作台原理,使用与维护
2020-05-27
-

大鼠补体蛋白4(C4)ELISA试剂盒说明书
2020-05-27

加载更多