ADC的毒性来自哪里?
①ADC的适应症正在迅速扩大,逐渐从晚期阶段转向早期阶段,从单一疗法转向联合策略。
②大多数ADC的毒性特征与其有效载荷的细胞毒性相似。
③某些ADC也可以观察到非常规和潜在的危及生命的毒性,需要对这些事件有更多的了解,并优化诊断和管理实践。
④业界正在寻求多种药理学修饰策略以试图改善ADC的耐受性,包括抗体部分,接头和/或细胞毒性有效载荷的分子改变。
⑤在随机试验中探索不同剂量以及研究适应反应的剂量策略可以优化ADC的使用,这可以最大限度地提高其对每种适应症的治疗价值。
⑥目前正在进行广泛的努力,以确定接受ADC治疗的患者的毒性生物标志物,并开发能够预测和/或早期发现毒性的诊断工具。
01
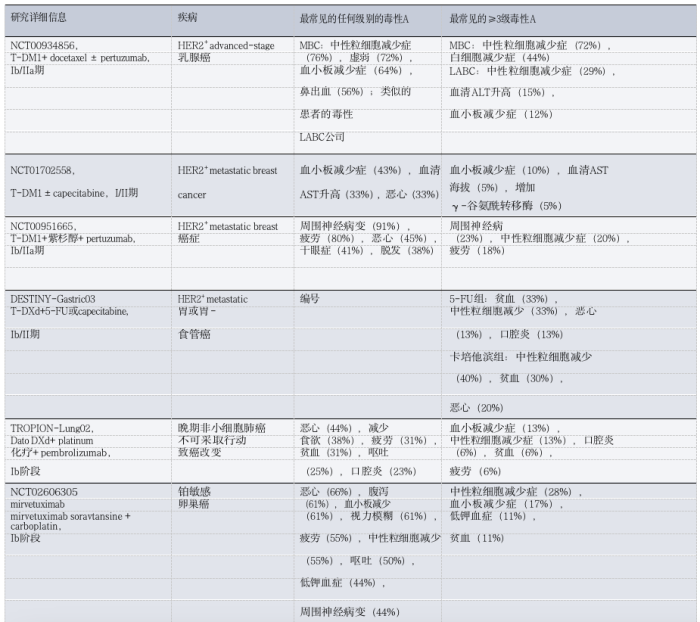
到目前为止,FDA和EMA已批准六种ADC药物用于实体瘤患者。下图描述了每种ADC的组成(就靶向抗原,单克隆抗体类型,有效载荷和接头而言)、目前批准的适应症、每种药物观察到的最常见毒性(如图1和表1)。每个ADC的不良反应特征通常是靶向和脱靶效应的混合,后者通常决定最大耐受剂量。在许多ADC中不同程度地观察到的常见不良反应包括疲劳,脱发,血细胞减少和胃肠道紊乱。
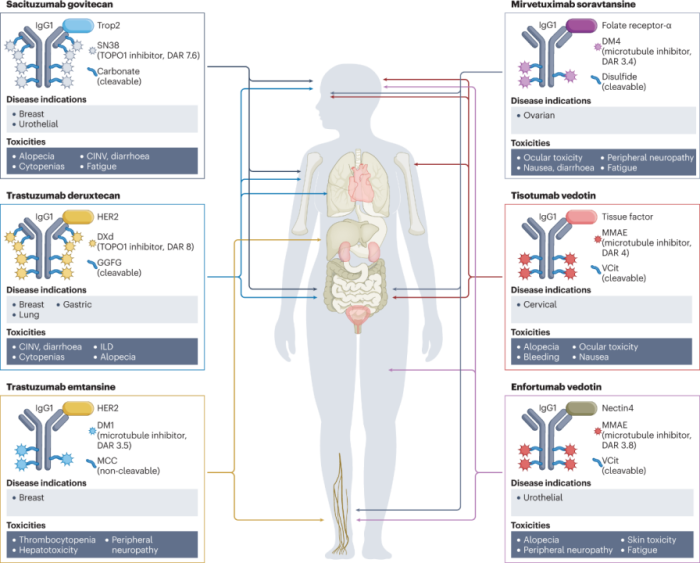
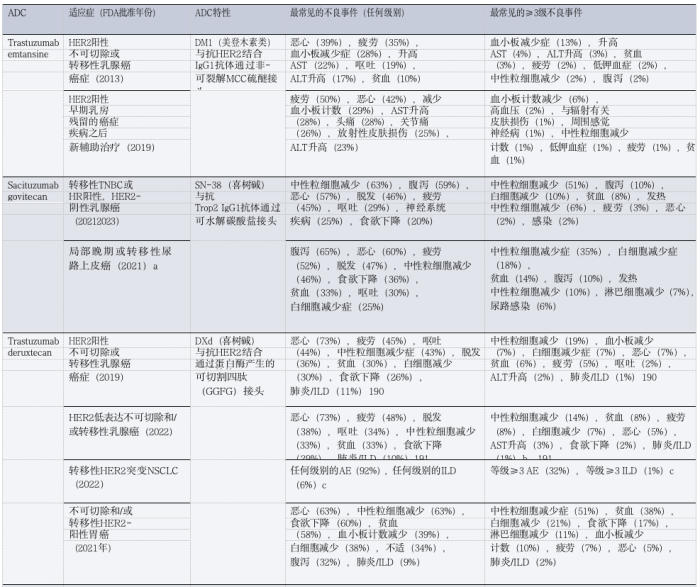
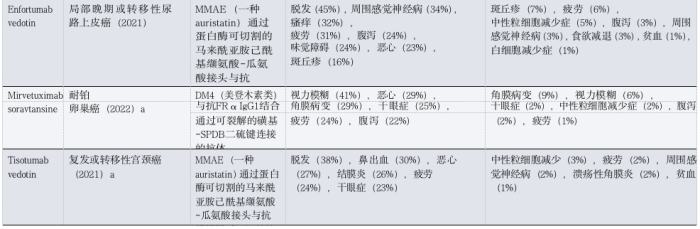
表1 :FDA批准的ADC在实体瘤患者中的毒性
鉴于分子量较大,ADC通常通过静脉注射给药。体内实验的数据表明,这种给药途径可能与某些ADC的活性降低和严重的皮肤毒性有关。注射后,理想地ADC应当在循环中保持完整,并且仅在靶向肿瘤细胞内或附近释放其细胞毒性有效载荷。ADC结构的微小改变通常会导致药物的药代动力学和/或药效学特征发生巨大变化(表2)。
注射后,ADC通常作为完整ADC(>组成的90%),未结合药物(或药物接头)和解离抗体的动态混合物在血流中循环。从循环中,ADC逐渐扩散到身体组织的间质空间,最终到达靶向肿瘤细胞,估计实体瘤的比例约为0.1%。
一旦ADC到达肿瘤微环境(TME),通常认为它会结合癌细胞表面表达的靶抗原,在内体内发生内化,并通过溶酶体中的化学或酶促裂解释放有效载荷,最终导致坏死或凋亡,这取决于有效载荷的作用机制和靶位点达到的浓度。
更疏水的有效载荷(例如单甲基auristatin E(MMAE)和exatecan衍生物)能够在细胞内与抗体解偶联后扩散到靶细胞之外,从而对抗原阴性细胞产生“旁观者杀伤”作用,可以增强某些ADC的抗肿瘤活性。
这种效应也构成毒性的决定因素:释放的有效载荷也可以通过被动扩散或转运蛋白介导的摄取进入相邻的非恶性细胞,可能导致脱靶细胞毒性。
除了传统上公认的肿瘤细胞内靶向有效载荷释放机制之外,某些ADC不需要抗原参与和内化就能释放细胞毒性有效载荷。例如,sacituzumab-govitecan被证明可以在TME内细胞外释放其SN-38有效载荷,这种机制可能解释了这种和其他ADC的活性和毒性。
表2 :ADC毒性的药理学决定因素
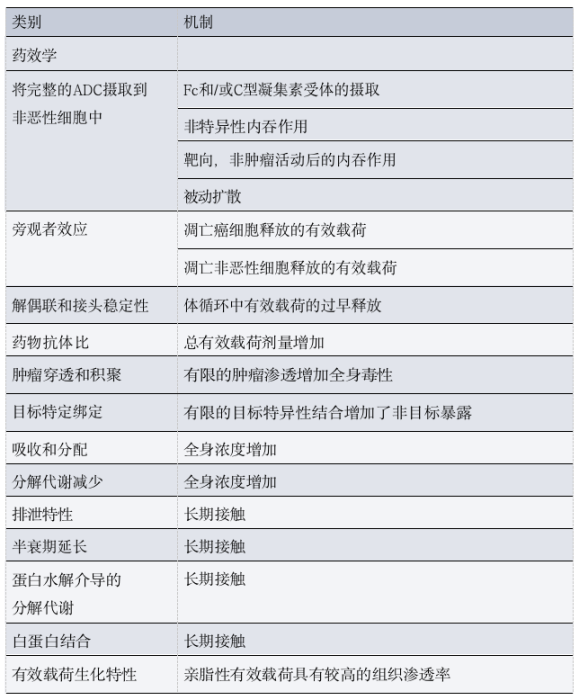
如上所述,ADC的大多数部分不到达肿瘤细胞,并且通过特异性和非特异性机制的组合逐渐降解,然后消除,包括靶介导的清除,Fcγ受体(FcγR)介导的摄取和/或位于各种组织中的巨噬细胞的胞饮作用。
重要的是,在进行降解和排泄之前,利用巯基马来酰亚胺化学物质(占大多数批准的ADC)从ADC释放的有效载荷-连接子复合物可以与血清白蛋白的游离半胱氨酸残基反应,从而产生长寿命的白蛋白-连接子-有效载荷加合物。
02
ADC具有模块化的结构,对其任何关键组件的微小修改都可能导致临床特征的重大变化(图2)。在本节中将剖析每个ADC成分的相对贡献,以及患者特征在所观察到的毒性类型和严重程度中的作用。
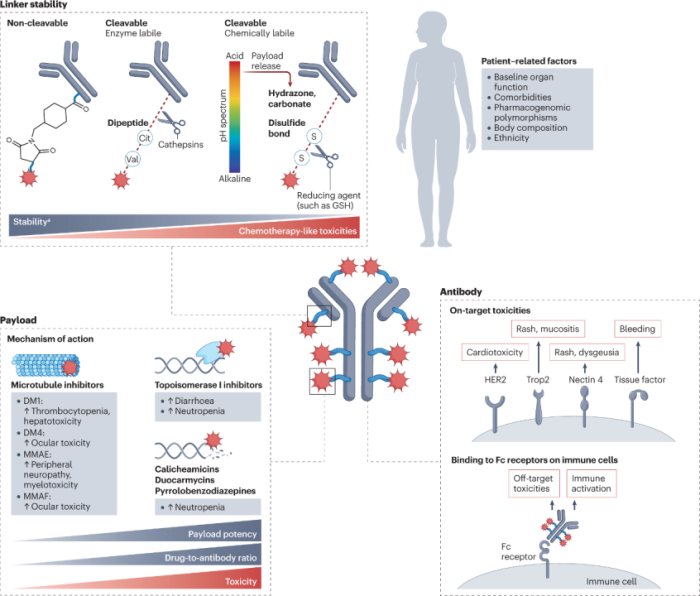
2.1 有效载荷
根据ADC开发背后的基本原理,预期靶向抗原将确定药物的毒性特征。但是临床经验表明,与ADC相关的大多数不良事件在频谱、发生率和严重程度上与有效载荷主干相似,并且共享相同有效载荷的不同ADC通常具有相似的毒性特征,而不管目标抗原的差异如何。
这些毒性可以大致分为与抗体靶向的抗原无关的脱靶,脱瘤效应,以及由抗体与位于非恶性组织中的同源抗原结合产生的靶向,脱瘤效应。
脱靶,肿瘤外毒性在大多数ADC的毒性特征中占主导地位,通常导致类似有效载荷的不良反应特征。
ADC的脱靶,肿瘤外毒性的关键机制被认为至少部分与体循环中有效载荷的过早解偶联有关,这导致游离细胞毒性有效载荷扩散到肿瘤外区室。这种有效载荷通常是亲脂性分子,能够渗透质膜并进入非靶向非恶性细胞。
如前所述,部分有效载荷也可能与血清白蛋白和其他含有巯基的循环血浆蛋白结合,这可以增加有效载荷-接头复合物的半衰期,并可能导致有效载荷沉积在非恶性组织中。
除了荷载从ADC中解离的机制外,还有其他机制被认为介导非恶性细胞对细胞毒性荷载的暴露,包括非特异性内吞作用,在非恶性细胞内完整ADC的内吞作用;以及靶外、受体介导的摄取作用,这是由抗体骨干的Fc区与免疫细胞表达的Fc受体相互作用引起的。后一种机制可能与高度稳定的ADC更相关,这些ADC与荷载的过早解离和释放进入循环有限相关,因此更有可能将完整的ADC遇到非恶性组织。无论机制如何,非恶性细胞对有效载荷的脱靶暴露程度最终决定了药剂的耐受性,使得有效载荷的选择成为任何ADC设计中的关键决策。
2.2 链接子
如上所述,在接受ADC的患者中导致脱靶毒性的主要机制可能与从缀合物释放有效载荷的时间和定位有关。这些特征在很大程度上取决于接头的稳定性和药理结构,因此可能对ADC的毒性特征产生重大影响。
理想的接头足够稳定以将有效载荷递送至预期部位,但也足够不稳定以在肿瘤内或肿瘤附近释放有效量的有效载荷。
除了接头稳定性之外,用于将有效载荷与抗体连接的特定化学物质以及药物与抗体的比率(DAR)都可能对ADC的毒性特征产生影响。
2.3 抗体
ADC的大部分毒性由接头-有效载荷复合物决定,但是尽管是具有相同有效载荷和接头的ADC,由于靶向,非肿瘤毒性,其不良反应也可能有很大差异。这些事件与特定靶标的参与或有效载荷在表达ADC靶标的非恶性组织中的积累有关,因此根据靶抗原而变化很大。
在某些情况下,靶向毒性可能主导ADC的安全性:基于EphA2靶向MMAF的ADC MEDI-547就是这种情况,即使在低剂量下,它也与危及生命的出血和凝血事件有关,这可能与EphA2的靶向参与有关,EphA2是一种与新血管生成有关的受体。
为了最大程度地降低这种靶向毒性的风险,需要仔细选择ADC靶标,优先推荐肿瘤细胞(理想高表达)和非恶性细胞(理想低表达或不表达)之间表达的抗原。
总体而言,尽管抗体相关毒性通常不会主导ADC的不良反应,但已经观察到几种严重的靶向,肿瘤外毒性或抗体Fc部分介导的毒性。这些观察结果突出了这些化合物作用机制的复杂性以及每个ADC组分与耐受性概况的相关性。
2.4 患者相关因素
03
与联合用药策略相关的不良反应
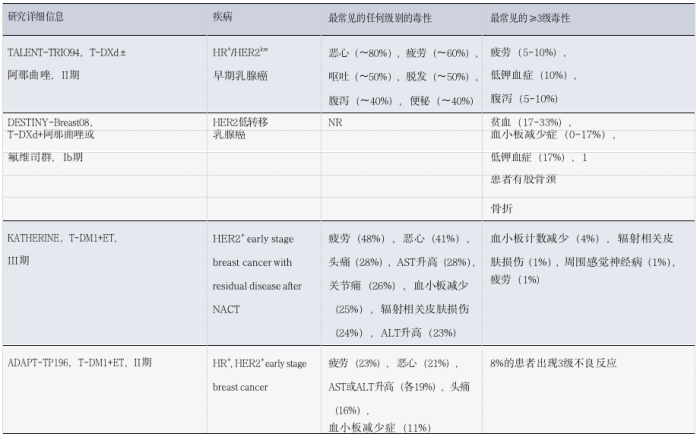
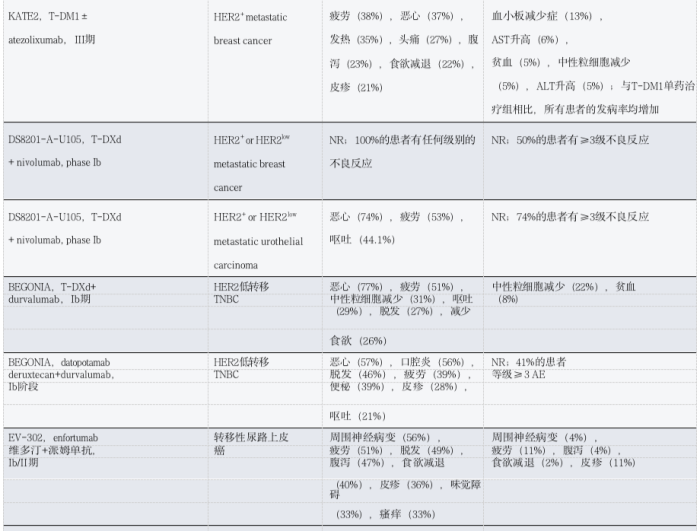
ADC为联合策略提供了多种机会,目的是实现加性或协同抗肿瘤活性。然而,这些组合还存在增加方案毒性的风险,这可能是由于重叠的不良反应或意外的协同作用。在本节中,我们概括了与不同类别的抗癌剂一起施用的ADC组合的可用毒性数据(表3和表4)。
3.1 ADC联合化疗
结合不同类型的化疗是克服耐药性和提高治疗效果的既定方法。然而,将ADC与化疗相结合会带来一些与重叠毒性相关的挑战。大多数试验的数据似乎表明,当ADC与传统化疗相结合时,毒性增加不可忽略,这可能是由于ADC有效载荷的脱靶、肿瘤外效应导致的重叠毒性。
表3 :ADC联合化疗在实体瘤患者中的毒性观察

3.2 ADC联合内分泌治疗
3.3 ADC与免疫疗法相结合
3.4 ADC与靶向治疗联合
表4 :ADC联合其他疗法对实体瘤患者的毒性观察
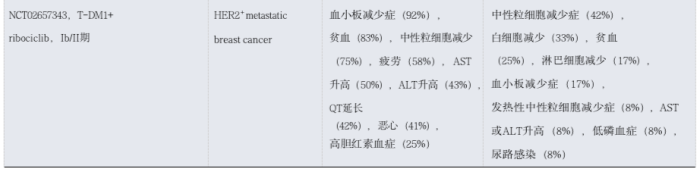
04
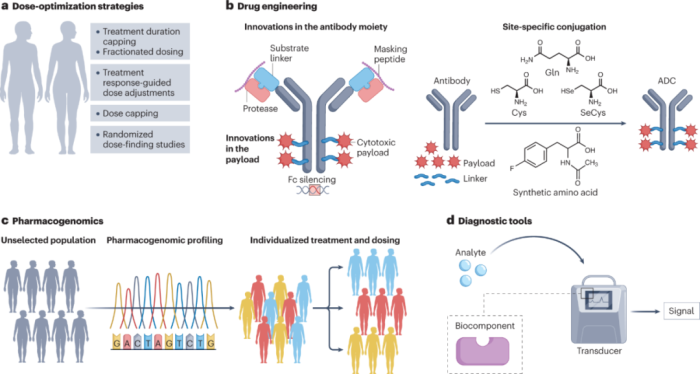
4.1 剂量优化策略
4.2 优化ADC设计
4.3 抗体部分的创新
4.4 连接子技术的创新
目前正在开发多种旨在提高ADC在系统循环中稳定性的策略,以优化安全性。这些方法能够制备具有可预测DAR和有效载荷附着位点的同质ADC,这可能与改善耐受性和更可预测的药代动力学有关。临床前证据表明,这些结合策略可以改善安全性。临床前数据表明,使用该策略开发的ADC保留了活性并改善了药代动力学特性,目前正在进行临床测试。
4.5 有效载荷方面的创新
4.6 药物基因组学
4.7 诊断工具
总结与展望
 主要参考文献
主要参考文献
[1] Tarantino P, Ricciuti B, Pradhan SM, Tolaney SM. Optimizing the safety of antibody-drug conjugates for patients with solid tumours. Nat Rev Clin Oncol. 2023 Aug;20(8):558-576. doi: 10.1038/s41571-023-00783-w. Epub 2023 Jun 9. PMID: 37296177.
[2] Jiang, Z. et al. A multiple center, open-label, single-arm, phase II clinical trial of MRG002,
an HER2-targeted antibody-drug conjugate, in patients with HER2-low expressing advanced or metastatic breast cancer. J. Clin. Oncol. 40, 1102–1102 (2022).
[3] Yamaguchi, K. et al. Trastuzumab deruxtecan in anti–-human epidermal growth factor receptor 2 treatment-naive patients with human epidermal growth factor receptor 2-low gastric or gastroesophageal junction adenocarcinoma: exploratory cohort results in a phase II trial. J. Clin. Oncol. 41, 816–825 (2023).
[4] Nguyen, T. D., Bordeau, B. M. & Balthasar, J. P. Mechanisms of ADC toxicity and strategies
to increase ADC tolerability. Cancers 15, 713 (2023).
[5] Hasan, M. M., Laws, M., Jin, P. & Rahman, K. M. Factors influencing the choice of monoclonal antibodies for antibody–drug conjugates. Drug Discov. Today 27, 354–361 (2022).
[6] Nicolò, E. et al. Combining antibody-drug conjugates with immunotherapy in solid tumors: current landscape and future perspectives. Cancer Treat. Rev. 106, 102395(2022).
[7] Schmid, P. et al. Abstract PD11-08: PD11-08 Trastuzumab deruxtecan (T-DXd) + durvalumab (D) as first-line (1L) treatment for unresectable locally advanced/metastatic hormone receptor-negative (HR−), HER2-low breast cancer: updated results from BEGONIA, a phase 1b/2 study. Cancer Res. 83, PD11-08-PD11-08 (2023).
[8] Waks, A. G. et al. Phase Ib study of pembrolizumab in combination with trastuzumab
emtansine for metastatic HER2-positive breast cancer. J. Immunother. Cancer .
医药速览
展源
何发
相关文章
-
联合疗法发掘中性粒细胞的抗肿瘤活性
2023-02-23
-

何时必须进行重现性实验?
2025-02-05
-

革新性的QuEChERS方法
2020-05-27
-

手性药物的色谱分析
2020-09-01
-

专用性芯片实验室的研发
2020-05-27
-

专用性芯片实验室的开发
2020-05-27
-

重复性、重现性不好,怎么找原因?!
2024-02-01
-

【色谱分析】何时必须进行重现性实验?
2024-12-17
-

实验室中常见的易燃性物质
2022-03-10
-

实验室中常见的易燃性物质
2023-02-10

加载更多