如何解决色谱柱过载?
特别是小伙伴做有关物质方法开发中,经常会遇到一组分析物中同时包含了较高浓度的主成分(也就是药物活性成分)和很低浓度的杂质(包括工艺杂质及降解杂质)。而为了兼顾低浓度杂质的灵敏度,必然要增大进样体积,或者提高进样浓度,确保定量的准确性。因此,某些时候就会造成色谱柱的过载。
色谱柱的过载又可以分为质量过载和体积过载。
质量过载
质量过载又称为浓度过载,就是指在小体积进样时(体积未过载),由于进样浓度较高,靠近谱峰峰带的固定相被饱和,也就是说,进样某一组分超过了色谱柱的载样量而出现过载的现象。一般表现为色谱峰峰形拖尾,柱效较低。
在小体积进样时,如果质量未超载,随着样品量的增加(a<b<c),谱峰面积相应增加(Aa<Ab<Ac),但是峰宽并没有随之增加。谱峰也显正常。
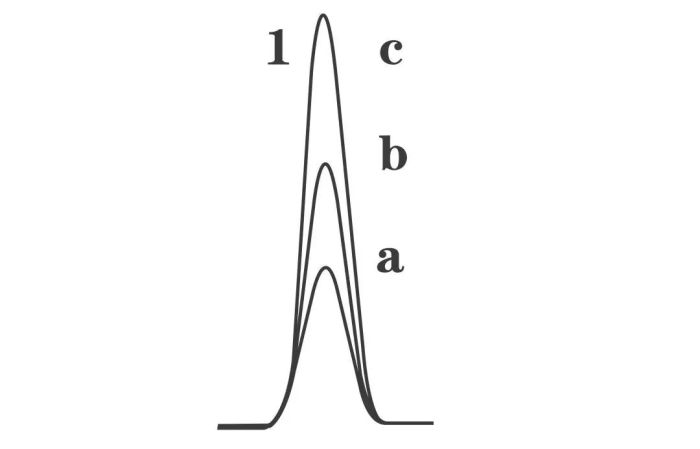
随着样品量继续增加,进到色谱柱中的样品达到饱和,谱峰就变形了。
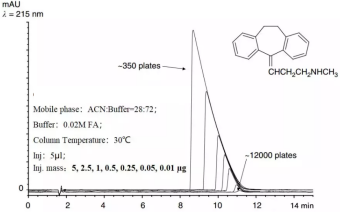
从图2可以看出,随着进样质量不断增加,谱峰峰宽不断增加,最终变成了直角三角形的形状,同时谱峰的理论塔板数也不断降低。通常,对于内径为4.6mm的色谱柱,其载样量<50μg。如果是做方法转移到其他色谱柱上,则需要调整进样量,防止出现过载。
载样量主要与色谱柱固定相和待分析物的性质有关。首先固定相类型不一样,品牌不一样会造成载样量较大的差异。其次待分析物质性质也会直接影响到色谱柱载样量。例如离子态的碱性化合物就很容易过载,不仅无法达到<50μg的量级,有时候甚至1μg的量就能造成过载的现象。因此在常规疏水反相中,分子态的碱性化合物比离子态的碱性化合物有着更高的载样量。目前的推测原因是,离子态间互相排斥作用使得待分析组分在固定相表面更易达到饱和而造成过载。同时离子态的带正电的碱性化合物也更容易和固定相中未键合的活性硅羟基发生次级相互作用。针对质量超载的问题,最简单的方法则是减少进样量。
另外,混合样品进样中过载还会导致峰保留时间的变化。

例如图3中,A’,B’为AB组分单独进样时的保留分离情况。A,B为混合进样时的保留分离情况。过载的B不管是单独进样还是混合进样,均保持稳定,而A由于过量B的存在,在混合进样时,保留时间提前。
虽然每个成分的过载是相对独立的,但是在混合样品进样过程中会引起的分离度问题。这是由于环境对组分的影响。其中某一组分过载很可能造成混合进样时保留时间相对于单独进样时有所改变。
体积过载
进样体积太大通常会导致较宽的平头峰。
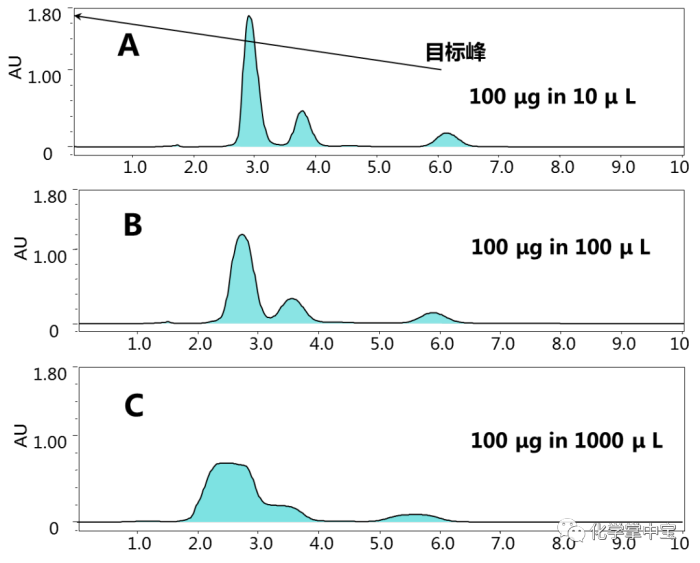
从图4可以看出,随着进样体积的增大,峰宽逐渐变宽,峰分离度降低。
另外体积过载还会影响峰保留时间,体积过载对保留时间短的组分影响更大,而对于较后面流出的峰影响较小。
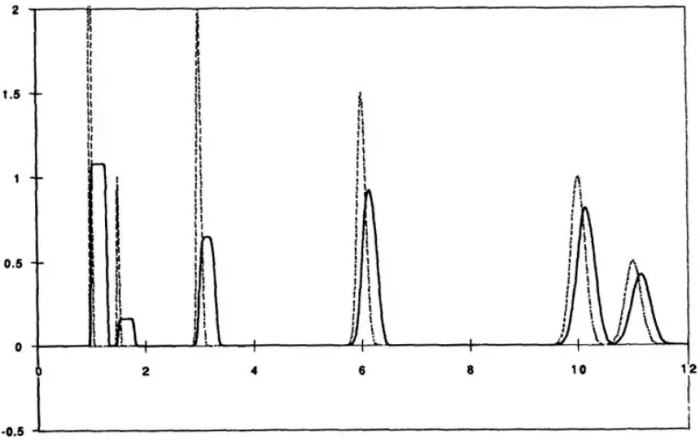
图5中虚线为正常体积进样,实线色谱图为体积过载后的色谱图。
那么,如何选择合适的进样体积呢?
对于在最佳流速下 ,允许样品进样的最大体积为:
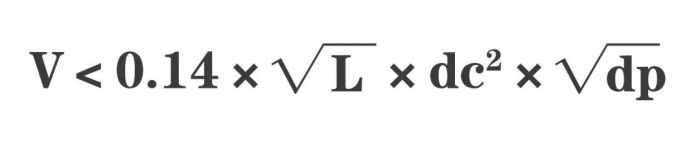
其中:L为柱长(mm),dc为内径(mm),dp为粒径(μm)
如果小伙伴嫌弃公式太繁琐,也没有关系,贴心的小编已经主动把我们常用的各规格色谱柱列出:

尽管上表中各个数据是严格按照公式计算出来的,但是这个数据并不绝对。色谱是经验科学,较之其他学科需要更多的实践。当然,理论也为我们指引了方向,让我们能少走弯路。
影响过载的因素及解决办法
柱容量越大越不容易过载。决定柱容量的指标是柱截面上固定相的面积占比,它与空容、填料的比表面积、表面健合率等色谱参数有关。
需要注意的是,增加柱长并不能增加柱容量,因为样品进样后不可能立即分布于整个色谱柱,同样因为无限直径效应的缘故,增大柱内径也不能增大柱容量。
显然,减小进样量可以缓解过载,有时还能够达到分离杂质的效果。进样量减小一半,主成分前相邻杂质峰从主成分峰中分离出来,但方法对杂质的检出能力也随着降低。
柱容量一定时,分配到固定相中的量越少,保留越小,柱越不容易过载。理论上,在固定相中不分配时,组分不保留,再大的进样量也不会出现过载。对于C18/C8健合固定相,可以通过增加有机相比例减小组分在固定相中的分配来缓解过载,当然,随着有机相的改变,方法选择性也会发生变化。
4、组分的存在方式
对于易解离组分如酸碱性物质,在流动相缓冲容量足够的情况下,谱带上任一点解离型(离子)和非解离型(分子)的比例始终一致,离子型和分子型相伴以恒定的比例流出色谱柱,出现的色谱峰是离子型和分子型的叠加。
如果其中一个组分过载,表现出一个拖尾的色谱峰,另一组分虽未过载,但由于上述原因,也会表现为和过载组分形状一致大小不同的过载峰。因此易解离组分的峰型由过载的那一种存在方式决定。
一般离子型比分子型组分更容易过载,故易解离组分的过载由离子型的过载决定,过载程度与其占比有关。一般通过调整流动相pH抑制组分解离可大大减小离子型比例,缓解甚至消除过载。
对于强酸/碱性物质,难以通过调节pH抑制解组分的解离,这个时候可以通过形成离子对复合物来减小离子型占比以缓解过载。同样地,过载由离子型决定,形成的离子对复合物越多,离子型就越少,过载就越能得到缓解。
更复杂的情况是既抑制解离又存在离子对试剂的时候,这个时候可以通过上述两方面来改变离子型的占比,既可以缓解过载拖尾,又可以调整保留。情况虽然复杂,但手段却更加灵活多样。
5、盐的浓度
对于离子型组分在C18/C8固定相上易于过载的原因,主要是因为离子型组分一旦进入固定相以后,离子间的排斥作用会阻止组分的进一步进入。
我们通常使用缓冲盐主要是为了维持流动相有足够的缓冲容量,但另一方面缓冲盐甚至是中性盐的加入还可以增加流动相离子强度,部分屏蔽组分离子间的相互排斥作用,减轻过载。同时盐还可以与离子组分形成离子对复合物,降低组分离子型比例来缓解过载。盐浓度越大,效果越明显。
缓冲盐与离子型组分形成离子对复合物所占比例到底有多少一直是笔者想知道的一个问题。其比例可以通过下式进行计算:
k’=x离子型﹒k’离子型+x离子对型﹒k’离子对型
x为各存在方式的占比,k’为相应的容量因子。
离子对复合物的保留应与分子型的保留相当,考虑到组分碱性较强,要测定组分分子型的保留值,需要完全抑制组分解离,流动相pH需要高达12以上,这在普通的C18柱上难以实现,故以伯氨基被酰胺取代的化合物代替该物质的分子型,并以此测得的保留值作为离子对复合物的保留值来及计算k’离子对型。
k’离子型用缓冲液盐浓度最低时(5mmol/L)的k’代替。
各缓冲液浓度下组分色谱峰均存在不同程度过载拖尾,故保留时间以色谱峰结束时的时间估算,应不至于产生太大误差(其实应于各条件下取低浓度组分进样,色谱峰不至于过载,能获得组分的准确保留值)。
6、梯度洗脱
在梯度洗脱过程中,一方面随着流动相有机相比例逐渐增加,组分在固定相中的分配也逐渐降低,过载的累积也就逐渐减轻。另一方面,对于低有机相比例洗脱时组分已经形成过载峰这一既定事实,梯度洗脱特有的所谓“谱带压缩机制”也可以进行部分“逆转”。
对于过载的谱带,组分浓度沿着柱入口到柱出口方向逐渐增加,而高有机相比例的流动相总是首先到达靠近柱入口的低浓度组分谱带区域,使它们不停追赶靠近柱出口的高浓度组分,最终使谱带压缩,以前过载拖尾的峰型得到缓解。
展源
何发

加载更多