qPCR数据可用性判断及数据处理方法

如何判断qPCR数据是否可用?

判断依据1,Ct值在合理范围内
Ct值的定义:PCR过程中,扩增产物的荧光信号达到设定的阈值时所经过的扩增循环次数。
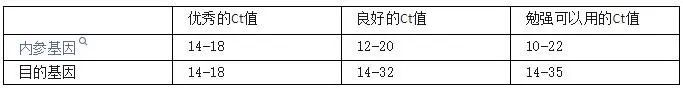
特别是目的基因的Ct值如果超过了35,也可以用,但是可能会影响最后实验结果的判断。所以Ct值偏大最好重复一遍。
a. Ct过大:通过提高模板浓度等进行改善;
b. Ct过小:通过稀释模板等进行改善。
判断依据2,溶解曲线(Dissociation curve)
Ct当然是首要看的数据值,但是紧接着就要看溶解曲线了,如果溶解曲线不对,那么Ct再好都要重来。
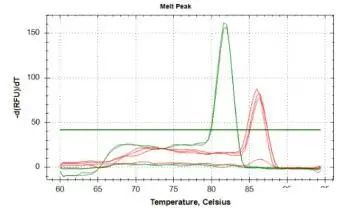
熔解曲线上有特征峰(Tm,DNA双链解链50%的温度),一般通过熔解曲线判断扩增产物是否单一。
1)TM在75-90之间;
2)单峰无杂峰;
3)峰距在5个TM内最好。下面展示比较好的例子
下面是异常的溶解曲线,如果是下面跑出来的Ct值,是肯定要重新做的。
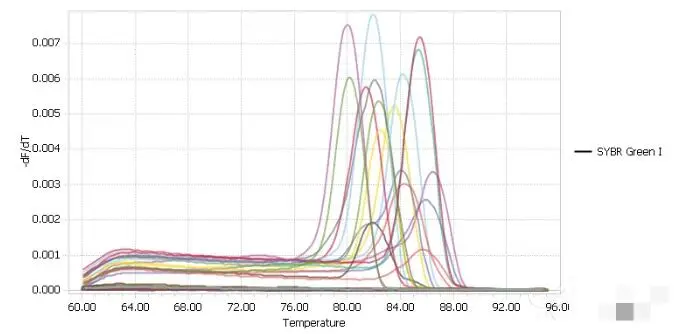
熔解曲线主峰前有杂峰
可能原因:存在比目的片段短的非特异性片段,也有引物二聚体的可能,此种情况下大概率需要重新设计引物了。
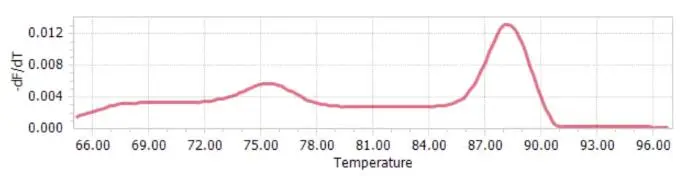
熔解曲线主峰后有杂峰
可能原因:大多由非特异性扩增引起,存在比目的片段长的非特异性片段。可通过调整稀释倍数、减少引物等来进行调整。
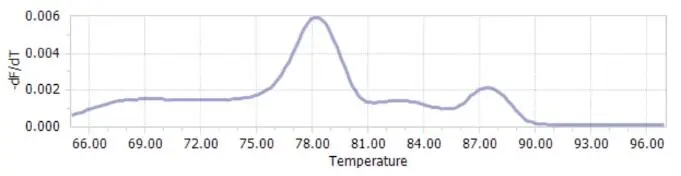
熔解曲线的问题,小伙伴们还是主要注意,引物设计和浓度是否有问题,同时操作时注意污染和镁离子浓度是否过高。
判断依据3,扩增曲线(Amplification curve)
扩增曲线(Amplification curve):随着PCR反应的进行,荧光信号强度随着扩增产物的增加逐渐增强,通过荧光强度检测扩增产物量的变化。
理想的扩增曲线是S型,有明显的四个时期
1)曲线具有平台期;
2)Fluorescence至少在3以上;
3)曲线无二次抬头。
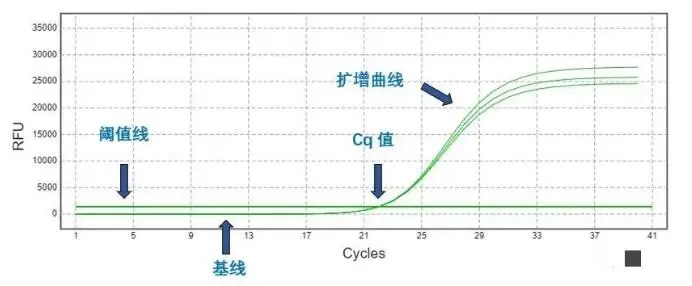
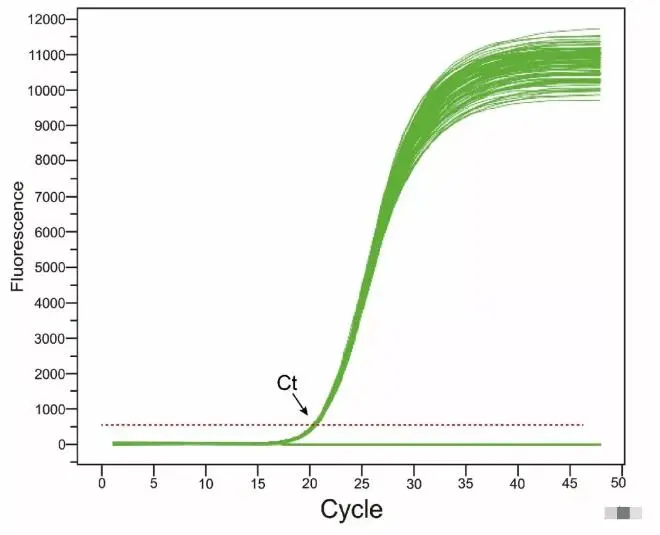
下面这个是好的例子
1. 没有对数增长期的扩增曲线,无Ct值
可能原因:引物或探针降解;模板量不足或模板降解。建议试剂不要反复冻融;
2. Ct值出现过晚的扩增曲线
可能原因:扩增效率低,建议各位小伙伴可以使用核酸电泳优化反应条件,比如降低退火温度;(当ct值较大>38,本人试过在反转录时即采用特异性引物进行反转录,并加大核酸浓度,效果有所改善)
3. 扩增曲线出现向下或向上的尖峰
可能原因:反应过程中电压不稳定,也可能为卤素灯老化。平时我们大体看前面两个依据就够了,但是qPCR跑完了,最好这三个都留意下,这三个都没有问题,qPCR可以大胆进入下一步进行计算了。

qPCR数据处理方法

上个讲到判断qPCR数据是否可用,Ct出来如何计算相对表达量呢?
对于qPCR数据的分析主要是绝对定量和相对定量。
1. 绝对定量主要使用标准曲线的方法;对于科研小伙伴们,主要通过相对定量来分析目的基因的表达差异。
2. 相对定量,主要使用的方法为双标曲线法和2^-△△Ct
首先要明白的就是Ct值的定义:PCR过程中,扩增产物的荧光信号达到设定的阈值时所经过的扩增循环次数。
因此分析定量时目的基因Ct值取15-35较好,内参基因的Ct值一般在13-15左右较好。需要注意的是:平行孔之间Ct值相差不要超过0.5,这也是为何建议设置3个平行孔的原因。
目前计算基本上按照这个公式进行
公式=2^-ΔΔct
如果Ct值出来了,我们可以按照如下步骤一步一步来
1)求出所有样本ΔCt:目的基因Ct-内参基因Ct;
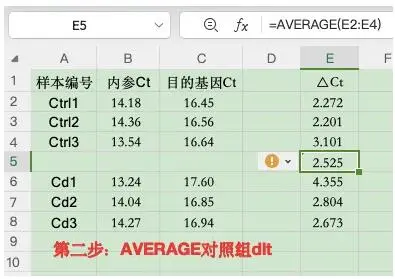
2)求出对照组ΔCt均值:使用函数 AVERAGE;
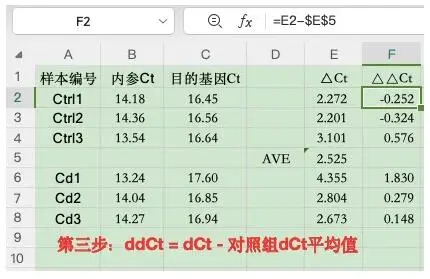
3)算出所有样本ΔΔCt: 单个样本ΔCt-对照组ΔCt均值
4)表达水平的差异倍数2^-ΔΔCt: 表格使用函数=POWER (2,-ΔΔCt)
举个例子
第一步:求出所有样本ΔCt:目的基因Ct-内参基因Ct;
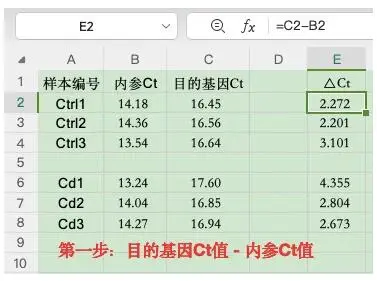
第二步:求出对照组ΔCt均值:使用函数 AVERAGE
第三步:算出所有样本ΔΔCt: 单个样本ΔCt-对照组ΔCt均值
最后一步:最后2^-ΔΔCt: 表格使用函数=POWER (2,-ΔΔCt)
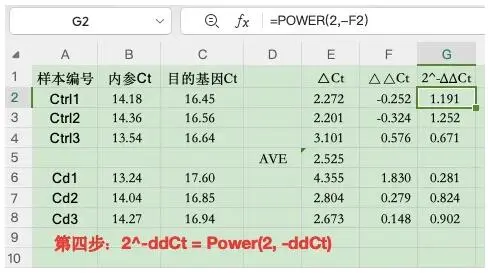
最后的G列的数据就是用来作图的值。
qPCR是实验中经常要分析的数据,仅次于表型考察数据的分析。
这个计算的Excel第一次计算好就可以了,后面来了新的数据可以直接替换数据,公式都还在,可以快速获得结果,不用像这样1,2,3,4操作。
人划线
Super Lab
展源
何发
相关文章
-

qPCR的常见问题
2023-11-08
-

新手须知的qPCR操作技巧
2023-04-17
-

如何抓住qPCR数据分析的关键?
2023-04-21
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

如何判断qPCR数据能不能用?
2024-09-29
-

qPCR常见问题及解决方案,快收藏~
2024-01-05
-

【新手须知】qPCR操作技巧详解!
2024-05-24
-

qPCR实验中引物设计的详细步骤介绍
2023-01-18

加载更多