细胞色素P450的反应表型分析
利用QTRAP研究分析细胞色素P450(CYP)反应表型
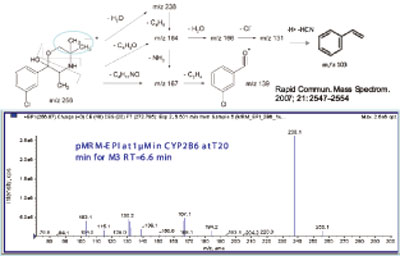
图1. 从CYP 2B6(M3)作用得到安非他酮主要代谢产物的结构信息和碎片裂解方式。
本文研究鉴定了各种浓度下的酶代谢的安非他酮的代谢物,实验结果证明QTRAP质谱十分适合作各类浓度的表型分析。
在评价药物相互作用和PK值的变化时,确定生物酶对药物的代谢作用至关重要。理想的条件下,应当知道代谢物及其相关的代谢途径,并用来作为不同临床相关浓度的酶动力学的定量研究。然而,在早期药物发现过程中,因为传统的代谢物鉴定和合成耗时又耗力,因而底物损耗被常常用作这些研究。由于灵敏度的限制,一般会在高底物浓度条件下,分离这些培养的代谢物。从如此高浓度的体外代谢研究结果看,似乎不会直接转移到体内的情形,基于这些原因,在早期的药物研究中限制了使用反应表型。
QTRAP是一类组合质谱技术的新机型,具备完整的三重四极杆MS/MS的质谱特点,也具备线性离子阱的功能,同时还将两者的功能巧妙地结合起来,创造出很多特有的“串联四极杆-线性离子阱”(以下称“杆-阱”)的新串联方式,在药代分析过程中,一次进样即可高效获得“全部有效信息”,经常被用作底物浓度低的动力学研究,包括表型分析。
#p#
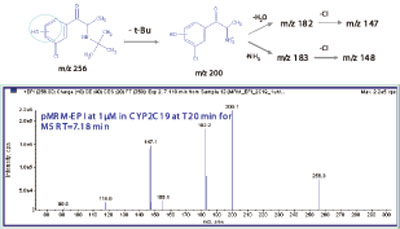
图2. 从CYP 2C19(M5)作用得到安非他酮主要氧化代谢物的碎片信息。
安非他酮在人体内被代谢为3种主要的代谢产物,是高浓度2B6底物的1,2,3代谢物。以前的体外代谢鉴定工作是由传统的离子阱质谱在浓度高达1mM底物的条件下完成的,这样就人为的造成了体外数据和临床数据的分割,因为临床有效浓度一般在0.5~1μM。本文研究鉴定了各种浓度下的酶代谢的安非他酮的代谢物,实验结果证明QTRAP质谱十分适合作各类浓度的表型分析。
药品和方法
传统方法是通过选择抗体或化学抑制剂,通过不同浓度的安非他酮结合人体细胞色素P450(rhCYPs)和人体肝脏线粒体(HLM)作表型分析。培养液中有磷酸钾(50mM,pH 7.4),氯化镁(5mM),rhCYP(pmole/ml,随不同CYP而改变),或者人体肝脏线粒体(HLM,0.5mg/ml),和不同浓度的安非他酮。加入原型辅酶Ⅱ(NADPH,学名烟酰胺腺嘌呤二核苷酸)启动反应,加入含内标的乙腈可中止反应。按时间0,5,10,20min收集样品。实验在AB 4000 QTRAP LC/MS/MS完成,液相色谱为岛津公司LC-20A和自动进样器,色谱柱2X100 Luna 3μM C18,定量实验和代谢物鉴定实验一次完成。
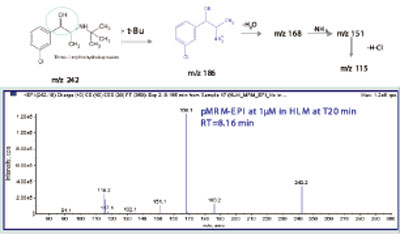
图3. 仅从HLM(人体肝脏线粒体)得到安非他酮主要代谢物的结构信息和碎裂机理。
Qtrap实验方法
1.pMRM-EPI 实验方法(pMRM切换至增强子离子扫描):通过LightSight软件自动设定和预计建立pMRM的母子离子对,这些MRM包含了所有可能产生的代谢物的母子离子,每对离子的驻留时间均为5ms,如果发现预计代谢物,仪器就自动切换到增强子离子扫描,即线性离子阱的高灵敏度子离子扫描,快速得到高质量的MS/MS谱图。由于此实验关注代谢物鉴定,所以各种浓度的样品均用一种方法来分析。
2.EMS-EPI实验方法(增强全扫描切换至增强子离子扫描):同样原理,在高浓度样品条件下,可以使用LightSight软件计算出可能代谢物,完成EMS IDA ,即高灵敏度的全扫描引导的数据相关的子离子扫描扫描。
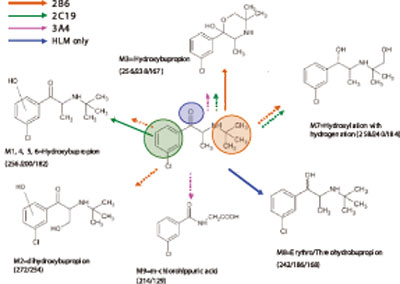
图4. 主要安非他酮代谢物和几种同功酶、HLM的形成途径。
MRM-EPI实验:从pMRM-EPI实验方法修正得MRM-EPI方法,它包括母药及所有鉴定出的代谢物的母子离子对表,并采用较长的驻留时间,每个EPI 的驻留时间为15ms,得到最佳的谱图。该实验侧重定量分析,但同时可以得到高质量的MS/MS谱图。
结果和讨论
QTRAP系统的分析策略
QTRAP MS具有三种独特的“杆-阱”采集数据模式,特别适合早期药物开发阶段研究新化学实体的表型反应。
1.pMRM-EPI 方法用来鉴定可能的代谢物和作半定量分析代谢物形成过程,新的pMRM 算法可以覆盖所有可能产生的代谢物及其碎片等信息,从而完成MRM扫描。这种采集方式的灵敏度很高,即使在底物浓度很低的情况下(0.1~1μM),也可以很好的检测和鉴定代谢物。增强子离子扫描EPI可以提供高灵敏度的MS/MS谱图,即使没有合成出标准品,也可以建立相应的离子对。与此同时,pMRM半定量结果,还可以帮助确定每一个CYP的主要代谢途径,这个也十分重要。

图5. M3(256/238/167在存在和不存在抗体或化学抑制剂的产生过程(1μM安非他酮)。
2.EMS-EPI实验可用于鉴定在整个样品反应面板上rhCYP培养的高浓度的主要代谢物,选择高浓度底物实验的好处是避免丢失pMRM 遗漏一些代谢物。
最终的定量结果可以通过串联四极杆MRM方法或MRM-EPI完成。用MRM-EPI的最大好处就是它不仅可以提供定量结果,而且同时还可以获得可信的MS/MS谱图,这在研究很多种代谢物的时候非常重要,可以有效地避免相似代谢物或底物带来的“假阳性”结果,还不需要用标准品来“甄别”这样的假阳性。基于同时得到底物耗损和代谢物产生的数据,就可以确定每一种CYP的底物代谢机理在HLM中的分布,还计算出酶动力学参数。
安非他酮表型结果
使用Qtrap(QqQ/LIT)新技术,共确定出8个主要的一相代谢物(M1-M8)及其相对于CYP2B6、2C19、3A4、1A2、2E1的代谢途径,并且通过pMRM-EPI测试不同浓度下的底物浓度还鉴定了一个非-CYP 酶途径(表1)。还有另一个代谢物M9也通过EMS-EPI分析100μM CYP3A4途径时被鉴定,而pMRM-EPI在分析1μM 底物时也将其鉴定出来(表1)。
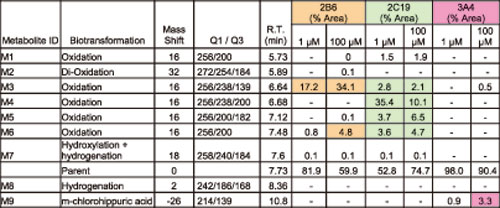
pMRM-EPI和EMS检测rhCYP培养出的安非他酮代谢物
CYP2B6是对T-丁基羟基安非他酮代谢物(M3,256/238/167,图1)产生主要作用的同工酶。而芳香环氧化代谢物(M1,4,5和6,图2)是主要由CYP2C19作用产生的,特别是在底物浓度低的情况下(< 10μM)。
还原代谢物(M8,242/186/168,图3)主要在HLM中形成,呈现出与非-CYP 有关。简而言之,代谢物的结构信息和相关的同工酶共同作用的代谢途径,从rhCYP培养的代谢物鉴定的结果来看就很清楚(图4)。
图6. M1,4, 5,6(256/200/182)在存在和不存在抗体或化学抑制剂的产生过程(1μM安非他酮)。
从MRM-EPI方法分析HLM 培养液同工酶抑制剂的结果也可以清晰地看到2B6 与产生M3代谢物有关(图5 ),而 2C19 则与产生 M1,M4,M5 和M6有关(图6)。用MRM-EPI分析用抑制剂在HLM培养的定量结果和单独用三重四极杆MRM的定量结果是一致的(图7)。
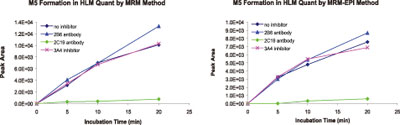
图7. 比较MRM和MRM-EPI定量结果(1μM 安非他酮)。
综上所述,CYP 2C19,CYP2B6 和CYP3A4,和安非他酮的几种羟基化代谢途径有关,其中CYP2B6 (酶的高 Km值),CYP2C19 只有在安非他酮在低底物浓度时产生代谢,其他涉及到 CYP2B6,CYP2C19,CYP3A4在安非他酮次要代谢途径被鉴定出来,而相关的分布也被预测。
结论
QTRAP仪器的MRM-EPI可高灵敏度和有效地分析早期表型反应,这是串联四极杆-线性离子阱有机结合在一起的范例。
pMRM-EPI是一种高灵敏度、高智能化地检测低浓度代谢物的手段,特别适合研究酶动力学。
结合QQQ/LIT的各种扫描方式,可以同时获得定量和定性结果。
LightSight 2.0软件高效定量和定性分析药物代谢物。
本实验方法特别适合早期表型研究,特别是样本量大的研究,有效避免错误的信息引起的重大损失。
展源
何发
热点文章
-
【必看】1分钟看懂qPCR曲线图
2025-11-27
-
【小知识】实验室单位换算!
2025-12-22
-
【必看】生物安全实验室分类
2025-12-18
-
GB/T 18242-2025 弹性体/塑性体改性沥青防水卷材
2025-12-05
-
【收藏】实验室易制毒、易制爆的化学品
2025-12-16
-
【收藏】金黄色葡萄球菌检测!
2025-12-08
-
【必看】实验室标识
2025-11-25
-
独立百天,新生启航:Solstice Advanced Materials中国首秀,锚定先进计算、可持续发展、生命科学新航道
2026年1月末,距离从霍尼韦尔正式分拆独立,并在纳斯达克挂牌上市将满百日时,全新的特种材料公司 Solstice Advanced Materials在上海举办了其独立运营后的首次中国媒体见面会。
作者:张明
-
安捷伦在中国:加速本土创新与绿色发展的双重推进
-
洞察未来,共谋发展 “ 数·智·未来 ” 安捷伦未来实验室媒体圆桌会成功举办
-
食品检验理化常用国家标准与要点
-
水分测定方法开发研究&检测相关问题故障分析解决解读
-
药物常用的晶型表征方法









评论
加载更多