如何精准表征活细胞内的时空动态蛋白质复合物
2021年1月4日,南方科技大学田瑞军教授团队在Nature Communications杂志上发表了文章,对基于生物质谱的蛋白质组学技术的蛋白质复合物规模化发现及定量表征技术进行了系统地梳理。今天咱们就聊一聊这项由田瑞军教授团队完成的研究通过设计和筛选新的过氧化物酶APEX2底物探针,开发出两种具有高度选择性的近程标记蛋白质组学方法,并利用其捕捉活细胞中无特定亚细胞空间定位的、瞬时的和弱的蛋白质复合物,从而绘制了具有分钟级别时间分辨率的时空动态相互作用蛋白质组。

细胞接受微环境的应激信号后通常会迅速组装相关的功能蛋白质复合物来应对和传递信号,而这些细胞信号转导过程涉及时空动态调控的蛋白质翻译后修饰、功能蛋白质复合物组装和亚细胞空间迁移。
例如,在酪氨酸磷酸化修饰(pTyr)介导的信号转导网络中,酪氨酸激酶和酪氨酸磷酸酶在分钟乃至秒钟时间尺度上精确地调控pTyr位点,而含有SH2或PTB等pTyr结合结构域的信号蛋白通过特异性地识别pTyr位点进而实现时空动态蛋白质复合物的组装和调控。
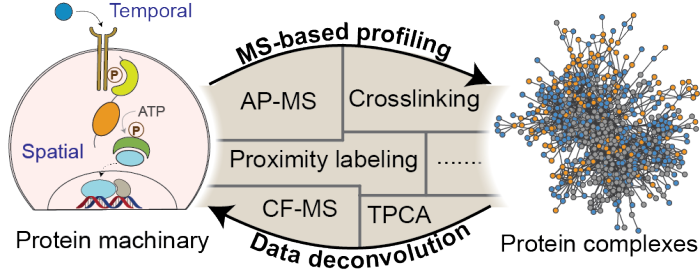
图1 时空动态蛋白质复合物的组装和调控概览,以及基于生物质谱的蛋白质组学主流技术介绍
2021年1月4日,南方科技大学田瑞军教授团队在Nature Communications杂志上发表了文章Spatiotemporal profiling of cytosolic signaling complexes in living cells by selective proximity proteomics,对基于生物质谱的蛋白质组学技术的蛋白质复合物规模化发现及定量表征技术进行了系统地梳理,主要包括亲和纯化与质谱联用技术(AP-MS)、近程标记技术(Proximity labeling)、基于化学探针的交联质谱技术(Crosslinking)、基于非变性色谱分离的复合物规模化分离鉴定技术(CF-MS)以及最新的热致蛋白近程共聚技术(TPCA)等。
随着各种定量蛋白质组学方法的日益成熟,AP-MS技术已经被成功地应用于动态pTyr信号复合物的精准表征。然而,细胞裂解后亲和纯化蛋白质复合物的方法会导致蛋白质空间定位和弱相互作用的丢失,更有可能导致复合物蛋白的重排,从而限制了其在具有生物学意义的时空动态信号复合物发现中的应用。本文介绍的这项由田瑞军教授团队完成的研究通过设计和筛选新的过氧化物酶APEX2底物探针,开发出两种具有高度选择性的近程标记蛋白质组学方法,并利用其捕捉活细胞中无特定亚细胞空间定位的、瞬时的和弱的蛋白质复合物,从而绘制了具有分钟级别时间分辨率的时空动态相互作用蛋白质组。
近程标记技术是一种可以实现活细胞中具有特定亚细胞器定位的原位蛋白质标记技术。通过结合定量蛋白质组学技术,这一技术已经成功地应用于鉴定特定亚细胞空间的蛋白质组及蛋白质复合物。以过氧化物酶APEX2为例,通过给具有特定亚细胞器定位的靶点蛋白引入APEX2,可以实现特定蛋白质的活细胞原位生物素标记、富集和蛋白质组学鉴定。
从原理上讲,在过氧化氢存在下,APEX2可以催化苯酚衍生物转化为自由基,并快速标记在临近10纳米左右空间范围内的蛋白的酪氨酸残基上。APEX2催化的自由基反应过程迅速而激烈,仅需要1 分钟(或更少)即可产生足够多的标记信号。基于上述快速标记原理,该近程标记蛋白质组学技术已经应用于在活细胞中捕获时空动态变化的膜蛋白复合物,但由于其标记背景高,该技术在胞质蛋白复合物等无特定亚细胞器空间定位的蛋白质复合物的捕捉中仍然受到极大限制。
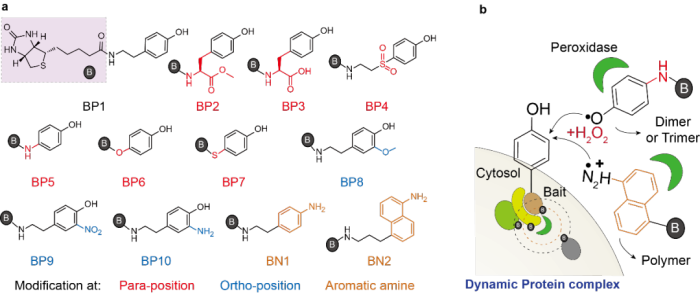
本文通过设计不同的生物素酚类似物探针以期实现对APEX2标记活性的有效调控,从而调控活细胞中蛋白质复合物的标记选择性。该项研究围绕生物素酚的苯酚结构设计了12种拥有不同吸电子基团和给电子基团等的探针分子(图2)。通过一系列的体外和体内标记活性和选择性测试,最终获得BP5和BN2两种新的生物素酚类似物探针。相比于经典的生物素酚探针,BP5和BN2探针均具有更高的体外反应活性和活细胞内蛋白质复合物标记选择性。该蛋白质复合物标记特异性主要归功于其高的反应活性和高效地形成二聚物、三聚物甚至多聚物的能力,从而达到在有限空间范围内高效标记复合物蛋白并迅速自我淬灭的效果。
图2 生物素酚类似物探针的设计(a)与反应机理(b)
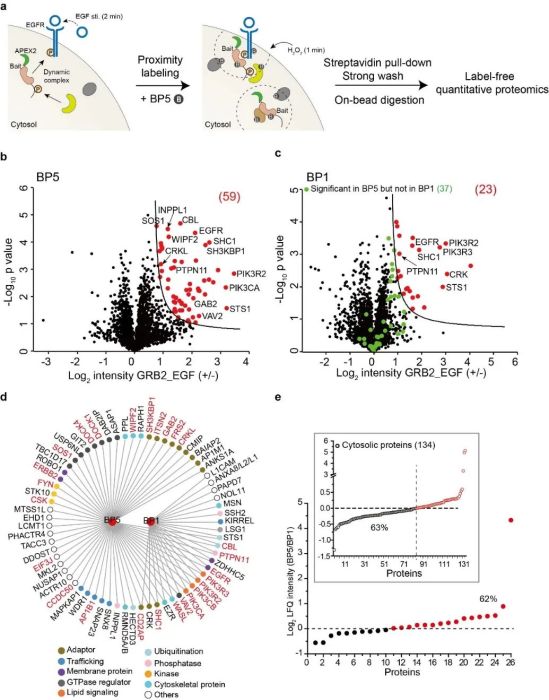
该项研究的特色是选取细胞质内的adaptor蛋白作为研究对象,通过结合定量蛋白质组学分析策略以期实现活细胞内时空动态蛋白质复合物的精准解析。以经典的EGFR信号通路中的GRB2蛋白为例,当EGFR受到EGF刺激激活后,GRB2蛋白会迅速与定位于细胞膜的EGFR及其他众多信号蛋白形成pTyr介导的动态复合物。所建立的近程标记蛋白质组学分析方法可以精准的捕捉活细胞中地GRB2动态蛋白质复合物。相比于BP1探针,BP5探针可以更为高选择性地捕捉GRB2相互作用蛋白(图3)。同时,BP5探针对其他多种adaptor蛋白均具有相同的高选择性复合物标记性能。
图3. BP5相较于BP1对于动态蛋白质复合物标记具有更高的选择性
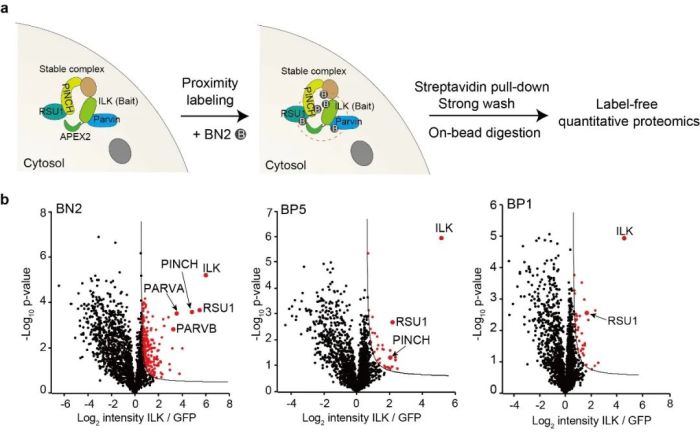
同时,在分析完全定位于细胞质的蛋白复合物IPP时,研究者们发现BN2探针可以高选择性地标记和鉴定所有IPP复合物蛋白ILK、PINCH、PARVA、PARVB和RSU1,而BP5和BP1探针仅能鉴定部分复合物蛋白。这一极高的标记选择性主要归功于BN2探针高的反应活性和形成多聚物的能力(图4)。
图4. BN2探针对于完全定位于胞质的蛋白复合物IPP具有极高的标记选择性
该项研究的另一大亮点在于,作者应用基于BP5探针的近程标记蛋白质组学策略解析酪氨酸磷酸酶STS1蛋白动态复合物,捕获了大量具有时间和空间层面动态变化的相互作用蛋白,进一步展示了该分析策略的有效性(图5)。更进一步地,通过将该近程标记蛋白质组学策略与传统的AP-MS技术进行头对头比较,作者发现两种策略均能有效的鉴定较为稳定动态蛋白质复合物及其动态变化规律;同时基于BP5的近程标记蛋白质组学策略可以鉴定大量分布于不同亚细胞空间的弱的及瞬时STS1相互作用蛋白。作者系统地采用发现近程标记和荧光共定位技术对多种相互作用蛋白进行了验证。
图5. 基于BP5探针的近程标记蛋白质组学技术成功捕获了STS1在EGF刺激后的时间和空间层面动态变化蛋白复合物
总之,该项由南方科技大学田瑞军教授团队独立完成的研究通过设计和筛选生物素酚类似物探针,将基于APEX2的近程标记蛋白质组学技术很好的应用到捕捉无特定亚细胞器空间定位的时空动态蛋白质复合物分析中。筛选获得的BP5和BN2探针可以根据标记选择性需求的不同配合使用,是针对传统生物素酚探针的有益扩展。据了解,该项研究发展的近程标记蛋白质组学分析技术已经在该团队及合作团队的多个研究项目中得到了广泛地推广应用。该技术不仅将为蛋白质复合物研究提供活细胞状态的、更为准确的结果,而且将为研究具有时间和空间层面动态变化(分钟级别)特点的生物学机制研究提供有力的蛋白质组学研究手段和解决方案。












评论
加载更多