【资讯】2个药品由处方药转换为非处方药!
相关药品上市许可持有人在2023年9月7日前就修订说明书事项向省级药品监督管理部门备案,并将说明书修订的内容及时通知相关医疗机构、药品经营企业等单位。
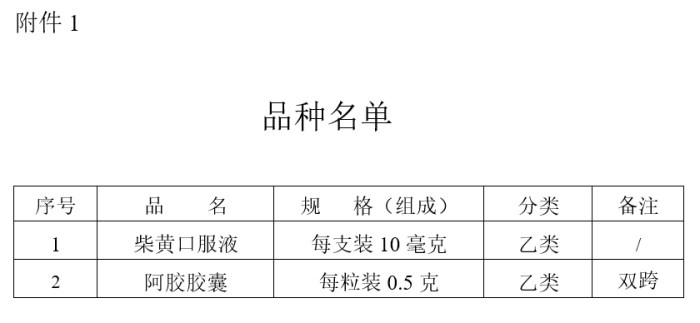
阿胶胶囊说明书
药通社
展源
何发
热点文章
-
【必看】实验室安全分类分级你都了解了吗?
2025-11-17
-
【谨记】实验室安全“四不”要牢记!
2025-11-10
-
气相色谱法科普知识
2025-11-18
-
【必看】1分钟看懂qPCR曲线图
2025-11-27
-
色谱柱应该怎么用?9步搞懂!
2025-11-12
-
【小知识】实验室单位换算!
2025-12-22
-
【必看】生物安全实验室分类
2025-12-18
-
安捷伦在中国:加速本土创新与绿色发展的双重推进
谈及2024年安捷伦大中华区的业绩表现,杨挺表示,尽管在2023年和2024年全球经济增速放缓,安捷伦中国的业绩仍稳步增长,尤其在制药、食品、环境等行业展现出强劲的市场需求。未来,随着中国科技创新和绿色发展政策的持续推进,安捷伦将继续深化在中国的布局,进一步推动本土化创新。 总结 2024年安捷伦媒体沟通会不仅展示了安捷伦在液相色谱领域的创新成果,也体现了公司在中国市场的深耕与战略部署。
作者:张明
-
洞察未来,共谋发展 “ 数·智·未来 ” 安捷伦未来实验室媒体圆桌会成功举办
-
食品检验理化常用国家标准与要点
-
水分测定方法开发研究&检测相关问题故障分析解决解读
-
药物常用的晶型表征方法









评论
加载更多