近日,Signal Transduction and Targeted Therapy(IF=38)发表了一篇病毒样颗粒(VLP)新冠疫苗的动物试验成果,从试验结果来看,该VLP纳米颗粒疫苗可能成为一种最具有潜力的新冠疫苗产品。
该篇题为《An RBD virus-like particle vaccine for SARS-CoV-2 induces cross-variant antibody responses in mice and macaques》(针对SARS-CoV-2的RBD病毒样颗粒疫苗在小鼠和恒河猴体内可诱导交叉保护抗体反应)研究论文报道了一种新冠VLP纳米颗粒疫苗能够在非临床动物模型中诱导优异的针对变异株的免疫反应。该研究由中国初创疫苗公司——派诺生物主导,派诺生物CEO晋竞博士及创新产品开发部高级总监李渊远博士为共同通讯作者,武汉病毒所张波博士和张亚南博士参与研究,李渊远博士和张亚南博士同为论文的第一作者。
VLP 纳米颗粒疫苗主要通过表达重组蛋白方式制备获得,正被广泛应用于生物医学领域。VLP纳米颗粒可进一步分为天然VLP和嵌合式VLP两种类型。天然VLP主要以乙肝和HPV病毒为代表,即其抗原蛋白可天然形成VLP颗粒;如无法天然形成颗粒,抗原则需通过“嵌合”方式展示于“颗粒载体”之上,主要代表为疟疾疫苗RTS,S及新冠疫苗CoVLP和GBP510。
VLP 纳米颗粒疫苗的优势主要在于其尺寸——纳米级大小可匹配大多数感染性病毒病原体,免疫原性接近天然病毒,利于激活免疫系统,可通过肌肉注射给药、鼻腔给药等方式操作。此外,VLP纳米颗粒的空间结构独特,可突出展示多种抗原之间的“保守”表位,从而有效诱导广谱中和抗体。
目前,VLP纳米颗粒已逐渐成为国际上广谱疫苗的主流技术平台,如新冠、广谱流感和广谱HIV疫苗等,均选择了VLP纳米颗粒技术。从已报道的临床数据可以看出,基于VLP纳米颗粒平台技术开发的CoVLP新冠疫苗,能够诱导比mRNA疫苗、亚单位蛋白/佐剂疫苗、病毒载体疫苗和灭活疫苗更高滴度的中和抗体,该结果提示VLP纳米颗粒疫苗或阵列抗原递送具有高度免疫原性。
目前,海外已经获批紧急使用的新冠VLP纳米颗粒疫苗有CoVLP(加拿大Medicago公司)与GBP510(韩国SK Bioscience公司)。此外,处于临床研究阶段的有SpFN(美国Walter Reed陆军研究所)、RBD COVID-19 vaccine(印度血清所)、VBI-2902a(美国VBI Vaccines公司)、ABNCoV2(丹麦Bavarian Nordic公司)、SARS-CoV-2 VLP(土耳其科学与技术研究院)以及IVX411(美国Icosavax公司)。国内使用重组蛋白VLP纳米颗粒技术研发新冠疫苗并进入临床阶段的企业只有派诺生物一家,且派诺生物开发的LYB001也是国内唯一进入3期临床试验并达到商业化生产要求的VLP纳米颗粒新冠疫苗。
此次研究中,派诺生物的研究人员设计了一种名为RBDM的VLP纳米颗粒疫苗(代号LYB001),通过针对SARS-CoV-2 刺突糖蛋白(Spike (S) glycoprotein)的受体结合域(RBD),使野生型(WT)的RBD以阵列形式展示于VLP纳米颗粒上。研究人员利用专有的Covalink®蛋白结合技术实现了模块化的生产流程:RBD蛋白和VLP载体分别在CHO细胞和大肠杆菌中高滴度表达(>3g/L),再分别经过独立的下游纯化工艺,两个纯化产物高效结合形成稳定的RBD-VLP(RBDM)原液,最后吸附于氢氧化铝佐剂制备成为LYB001疫苗成品。
(图源自Signal Transduction and Targeted Therapy)
研究结果显示,在GMP生产工艺条件下RBDM疫苗的纯度可达到>95 %,而且,动态光散射(DLS) 、高效液相分子筛(HPLC-SEC)和电子显微镜结果也证实了RBDM可稳健的形成VLP纳米颗粒(裸颗粒29.82nm,抗原颗粒35.86nm)。
目前已上市的第一代新冠亚单位疫苗大多是基于“非颗粒”形态的S蛋白三聚体(S-Trimer)或RBD蛋白抗原设计。对比这些已上市产品,RBDM也显示出对人体ACE2受体最强的结合亲和力(KD<1.0E-12M),证实了VLP纳米颗粒通过阵列展示可有效提升抗原生物活性。
(图源自Signal Transduction and Targeted Therapy)
在小鼠实验中,采用ACE2-RBD结合竞争ELISA方法对免疫血清中的中和抗体(nAb)水平进行了检定。结果显示,相比S-Trimer或RBD蛋白,RBDM可对绝大多数新冠病毒变异株(WT、Alpha、Beta、Gamma、Delta、Lambda和Omicron)诱导了更高的nAb反应,提升程度均接近一个数量级。为了进一步了解RBDM组较高的nAb反应是否仅仅是出于更高的整体结合抗体反应,研究人员计算了单个动物的nAb与结合抗体终点滴度的比值,即nAb占总结合抗体比例或抗体质量。结果显示,RBDM接种组的抗体质量均高于S-Trimer组。这些数据表明,RBDM疫苗可有效诱导更高水平的针对新冠变异株的抗体反应。
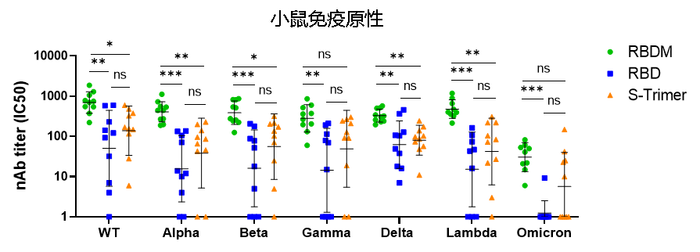
(图源自Signal Transduction and Targeted Therapy)
为了测试RBDM是否能够有效应对新冠病毒攻击,研究人员在第0、21和42天分别用10 μg或20 μg的RBDM对K18-hACE2转基因小鼠进行了三次接种。结果显示,与生理盐水和佐剂对照组相比,两种剂量的疫苗均诱导了更显著的nAb应答;而两种疫苗剂量之间没有观察到显著差异。第49天小鼠分别接受了105 PFU剂量WT和Delta株的攻毒,并于3天后解剖分析。研究人员通过对肺组织中的病毒载量检测后发现,疫苗组动物均未检测到活病毒,证明了RBDM疫苗的在小鼠模型异源攻毒下的有效性。
(图源自Signal Transduction and Targeted Therapy)
为了检验RBDM在非人灵长类动物(NHP)中是否具有免疫原性,研究人员在第0、28和56天分别用50 μg或25 μg RBDM或佐剂对照对恒河猴进行了三次接种。检测了抗S蛋白IgG后发现,两剂量组抗体滴度均较高,趋势相似。此外,真病毒中和试验证实了疫苗可诱导针对WT和Delta变异株的高滴度中和抗体反应。对WT的活病毒中和试验显示了相对较高的nAb反应,两次接种后的最高几何平均滴度(GMT)为3547,三剂RBDM后的最高几何平均滴度(GMT)为5552。与其他同使用过恒河猴为模型的疫苗临床前研究结果相比,这些结果高于已报道的疫苗(包括辉瑞和Moderna的mRNA疫苗)。此外疫苗还诱导了较高的IFN-γ和IL- 2细胞因子反应,证明了RBDM疫苗在具备突出抗体反应的同时亦可有效诱导细胞免疫反应。
(图源自Signal Transduction and Targeted Therapy)
随后在第78天,恒河猴接受了105TCID50剂量Delta株的攻毒。研究人员通过测量鼻拭子、咽拭子、肛门拭子和肺组织样品的亚基因组RNA (sgRNA)发现,与对照组相比,RBDM疫苗可有效降低病毒载量,其中肺组织中的病毒载量有超过平均6个Log的下降。研究人员还对每个肺组织样本进行了组织病理学评估。佐剂对照组的动物显示出严重的肺间质炎症和肺细胞增生,而接种了RBDM疫苗的动物肺叶中出现了非常轻微的局灶性组织病理变化,证明了RBDM在恒河猴模型异源攻毒下的保护性。
(图源自Signal Transduction and Targeted Therapy)
由于新冠变异株的肆虐,研究人员同时对恒河猴D70血清进行了假病毒法针对变异株的中和抗体检测,结果显示,虽然RBDM疫苗是基于野生株RBD抗原的设计,但其对Omicron BA.1、BA.4/5、XBB.1变异株均能产生良好的nAb滴度,其中OmicronBA.1和BA.4/5较WT株降低了3- 5倍,OmicronXBB.1变异株的nAb滴度降低了16- 19倍。由于恒河猴模型更接近人类,这些数据再一次强有力地证明RBDM疫苗的有效性,即使是对抗最新的变异株,RBDM依然可以诱导出高水平的nAb反应。
(图源自Signal Transduction and Targeted Therapy)
研究者对RBDM疫苗开展了全面的临床前安全评价,完成了大鼠急性毒理,食蟹猴重复给药毒理,兔局部刺激,豚鼠过敏以及大鼠生殖毒性I、II、III段(III段开展中)实验,结果均证明了疫苗的安全性。RBDM疫苗现已进入临床研究,迄今观察到的大多数(99%)疫苗相关的不良事件均为1-2级,证实了疫苗在人体上的安全性。
综上,该研究中描述的RBDM疫苗是现有的少数几款利用VLP纳米颗粒平台技术制备的新冠候选疫苗之一,也是国内唯一一个获批进入临床的新冠VLP纳米颗粒疫苗。由于平台的优势,该疫苗具有优异的免疫原性,可以在小鼠和NHP攻毒模型中提供针对变异株的保护。同时,RBDM疫苗也可有效诱导出针对最新变异株(如Omicron XBB)的中和抗体反应。此外,已开展的临床试验也充分证实了RBDM疫苗以及此VLP纳米颗粒平台的安全性和有效性。派诺生物正在积极开发和布局新冠迭代产品以及其他重大疾病的创新型疫苗管线,有望填补国内重组嵌合VLP纳米颗粒疫苗技术路线的空白。
原文链接:https://www.nature.com/articles/s41392-023-01425-4


















评论
加载更多