PD-L1抑制剂研究有新进展
s
背景介绍
s
因其并不直接攻击癌细胞,而是通过激活人体自身免疫系统来抗击肿瘤,具有良好的安全性及耐受性。其中,免疫检查点阻断疗法已成为当下最热门的免疫疗法之一,该疗法显著改变了目前癌症治疗的格局,而PD-1/PD-L1免疫阻断疗法正是最典型的代表。程序性细胞死亡受体(PD-1),是一种重要的免疫抑制分子,它可以下调免疫系统响应从而避免自身免疫病,可在T细胞、B细胞等免疫细胞表面表达。在肿瘤微环境中,肿瘤细胞和肿瘤相关APCs高表达PD-L1,肿瘤浸润性淋巴细胞在肿瘤抗原长期刺激下高表达PD-1。PD-L1与PD-1结合后可诱导T细胞凋亡、失能、耗竭,进而抑制肿瘤抗原特异性CD8+T细胞的激活、增殖和抗肿瘤功能,实现肿瘤免疫逃逸。因此阻断PD-1/PD-L1相互作用已成为肿瘤治疗的一种重要策略,在临床环境中已显示出突出的治疗效果。PD-1/PD-L1 抗体药物作为肿瘤免疫治疗的代表药物,在晚期恶性肿瘤治疗中取得了巨大的成功。然而,低应答率和免疫相关的不良反应限制了抗PD1/PD-L1抗体的使用。
研究成果
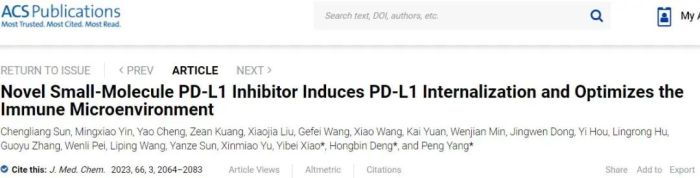
近日,中国药科大学药学院杨鹏教授、肖易倍教授与北京协和医学院邓洪斌教授合作,在药物化学领域顶尖期刊《Journal of Medicinal Chemistry》上面在线发表题目为“Novel small-molecule PD-L1 inhibitor induces PD-L1 internalization and optimizes the immune microenvironment”的研究论文,报告了一种创新的PD-L1小分子抑制剂S4-1,可诱导T细胞活化并逆转抑制性肿瘤微环境,阻断PD-L1/PD-1通路,抑制肿瘤生长。
S
研究详情
S
本研究报道了一类邻苯二甲酰亚胺类化合物,并进行了系统的构效关系研究。优选化合物S4-1蛋白水平IC50值为6.1 nM,显著抑制PD-1/PD-L1蛋白-蛋白相互作用。药效学评估过程中,S4-1通过降低PD-1/PD-L1相互作用,在细胞和动物水平恢复T细胞的活化,并逆转抑制性肿瘤微环境,增强免疫细胞的抗肿瘤活性。
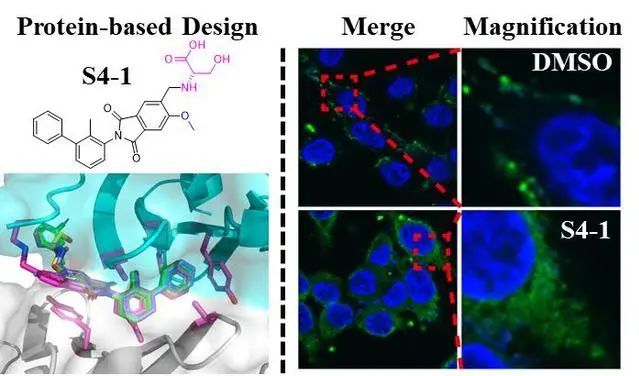
示意图:S4-1阻断PD-1/PD-L1相互
作用,诱导PD-L1蛋白内吞降解
S
研究数据显示,PD-L1二聚化和内化,改善其在内质网的定位,从而增强外周血单个核细胞对肿瘤细胞的细胞毒性。S4-1可以诱导PD-L1二聚化和内化到细胞质中,改善其在内质网的定位,从而增强外周血单个核细胞对肿瘤细胞的细胞毒性。因在内质网中富集,这可能导致随后的内质网相关降解,进一步降低PD-1/PD-L1相互作用。在肺和结肠直肠癌模型中,S4-1显著抑制肿瘤生长,抑制率达到88.8%,特别是在结肠癌症25 mg/kg治疗组中部分模型鼠的肿瘤被完全清除。免疫微环境结果显示,S4-1诱导巨噬细胞的M1表型极化,预示其可能通过T细胞之外的其他免疫途径,增加抗肿瘤疗效。毒理及药代动力学研究验证S4-1安全性良好和代谢稳定。该化合物目前已获得专利授权(CN 112979532 B),为肿瘤治疗提供了全新候选药物分子。
论文链接:
https://pubs.acs.org/doi/10.1021/acs.jmedchem.2c01801
中国药科大学官网
展源
何发
热点文章
-
【必看】1分钟看懂qPCR曲线图
2025-11-27
-
【小知识】实验室单位换算!
2025-12-22
-
【必看】生物安全实验室分类
2025-12-18
-
GB/T 18242-2025 弹性体/塑性体改性沥青防水卷材
2025-12-05
-
【收藏】实验室易制毒、易制爆的化学品
2025-12-16
-
【收藏】金黄色葡萄球菌检测!
2025-12-08
-
【必看】实验室标识
2025-11-25
-
独立百天,新生启航:Solstice Advanced Materials中国首秀,锚定先进计算、可持续发展、生命科学新航道
2026年1月末,距离从霍尼韦尔正式分拆独立,并在纳斯达克挂牌上市将满百日时,全新的特种材料公司 Solstice Advanced Materials在上海举办了其独立运营后的首次中国媒体见面会。
作者:张明
-
安捷伦在中国:加速本土创新与绿色发展的双重推进
-
洞察未来,共谋发展 “ 数·智·未来 ” 安捷伦未来实验室媒体圆桌会成功举办
-
食品检验理化常用国家标准与要点
-
水分测定方法开发研究&检测相关问题故障分析解决解读
-
药物常用的晶型表征方法









评论
加载更多