利用MIDASTM确证Biomarker
MIDASTM确证Biomarker
生物标志物的发现是一个复杂而漫长的过程,AB公司结合QTRAP系列质谱系统的独特功能与扫描模式,创造性地开发出MIDASTM(MRM Initiated Detection And Sequencing)工作流程,满足了生物标志物验证与确认的4S要点,可以准确、快速、简便地完成大样本量的生物标志物验证与确认工作。本文结合实际的应用案例介绍了这一技术。
生物标志物(Biomarker)的发现是一个复杂而漫长的过程。在此研究过程中可能会面临各种困难与挑战。其一,蛋白质类生物标志物在体内变化不大,难于检测。通常不是有和无的变化,而仅是体内浓度发生相应改变,这种变化量基本上都小于10倍,通常在5倍变化量之内;其二,个体之间,甚至于同一个体的不同批次样本之间,存在本底差异,难于区分。实验证明,临床样本之间的差别大于动物样本,而动物样本差异大于细胞培养样本;其三,最有效的标志物通常浓度很低,而样本量也有限,所以要求分析手段必须具备极高的灵敏度;最后,生物体内变化极其复杂,即使获得有很好灵敏度与特异性的单个标志物,要想通过设定此单个标志物的精确阈值来标定某一生理状态仍然非常困难。所以,通常生物体某一生理状态就需要由多个标志物共同来标定,而非单一标志物就可以完成。
一般来说,生物标志物的发现包括发现或鉴定(Discovery),验证(Verification),确认(Validation)三个步骤,而后再进入临床检验等更深入的阶段。鉴定步骤可以通过生物质谱仪与蛋白质差异表达定量等相关技术完成。但由于生物标志物必须具备广泛的代表性与标志性,所以验证与确认步骤的样本量通常是鉴定阶段的数十至数百倍,因此,验证与确认生物标志物的技术方法需满足4个要点(即4S要点):速度快(Speed),特异性高(Specification),灵敏度高(Sensitivity)和具有统计学意义(Statistics)。而目前常规的Western Blot或ELISA方法,由于成本高、速度慢,特异性抗体制备难度大等诸多技术难题,很难在进行大批量样本验证与确认的阶段中发挥主要作用。因而就迫切需要有新的技术完成此项重任。
由于充分地认识到生物体标志物验证与确认工作的重要性、复杂性和广大研究人员的迫切需求,AB公司在此领域投入巨大资源,结合QTRAP系列质谱系统的独特功能与扫描模式,创造性地开发出MIDASTM(MRM Initiated Detection And Sequencing)工作流程,满足了4S要点的技术要求,可以准确、快速、简便地完成大样本量的生物标志物验证与确认工作。QTRAP是具有革新性设计的液相色谱-串联质谱仪,是一台集优异的定性功能与定量功能于一体的质谱仪,它把四极杆-线性离子阱质谱技术首次结合在一起(如图1所示),既保留了串联四极杆质谱仪(空间串联质谱)的优点,如:母离子扫描(PS)、中性丢失扫描(NL)、MRM定量功能;以及线性离子阱(时间串联质谱)的所有优点,如子离子扫描灵敏度高,MSn,高分辨扫描等等,又克服了传统3D离子阱质谱仪的缺点,如低质量截止点(1/3效应)、“空间电荷效应”、碰撞效率低、定量差等。更重要的是,同时还开发出了空间串联+时间串联的联动新技术,如MRM-EPI,MRM-MS3,MRM-NL等等。MIDASTM工作流程就是建立在这一高技术平台之上的。
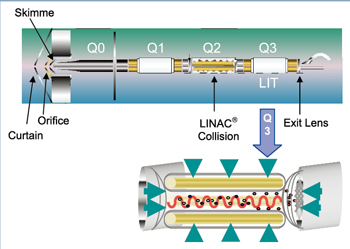
图1. QTRAP 仪器结构示意图:具备完整的三重串联四极杆质谱,又增加了线性离子阱的功能,还首次完成了这两类质谱功能的集合和联动。
通过用其它各类技术方法,包括蛋白质组学相关技术,基因组学相关技术,各类已发表文献等,发现出具有潜在生物体标志物性质的蛋白质或基因,利用已知的该蛋白分子的基因序列或氨基酸序列,就可应用MIDASTM方法进行大批量样本的蛋白分子验证与确认工作。
其主要工作模式如下:将分子的基因或氨基酸序列输入MIDASTM设计器软件的序列框,设定相关参数后,软件自动构建排列出MRM扫描模式所需要的母-子离子对(如图2所示)。而后,3200 QTRAP或4000 QTRAP质谱仪通过MRM扫描模式对大批量的样本监测,查看是否有此排列的母-子离子对出现。如若信号出现,证明此分子在样本中存在,仪器将自动切换至MS/MS扫描模式,确定此母离子的碎片离子信息,并再次鉴定并确认该分子的结构。如若在MRM扫描工作中,未发现预期的母/子离子对,就说明该分子在此样本中不存在。由于MRM扫描模式高效快速,且具有极高灵敏度,因此非常适合于高通量验证与确认生物标志物。
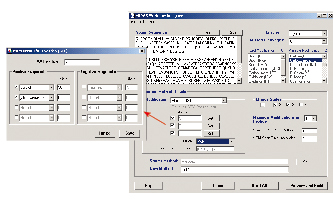
图2. MIDASTM设计器软件的序列框口,设定相关参数后,软件自动构建排列出MRM扫描模式所需要的母-子离子对。
应用实例
这里给出一个应用案例,通过4000 QTRAP LC-MS/MS质谱系统提供一种全新的技术方案,去进一步确证质谱已经鉴定出的低丰度蛋白质的存在与否。所有预期的胰酶酶切蛋白质所产生的多肽通过MRM扫描模式监测,验证其是否存在,一旦信号被检测到,仪器会立刻自动切换到高灵敏度线性离子阱 - 增强子离子扫描方式(EPI)采集数据,从而确认蛋白质的真实存在性。这种MRM触发的检测与验证方法最近也被用于蛋白质酶切后低丰度磷酸化肽的检测[4,5]。
人体mRNA剪拼体(Spliceosome)的蛋白质组成和其主要成份——小核糖核蛋白颗粒(snRNP)U1, U2,[U4/U5/U6](tri-snRNP)的复合物,如图3所示。 在mRNA前体的体外剪切拼接过程中,几种不同的复合物按一定次序组装在mRNA前体上。除如图3所示的snRNPs外,还有一些相关联的暂时性结合的拼接因子,其中有些因子的数量很少,浓度极低。为了鉴定这些因子,这些复合物经甘油梯度离心后,使用LC-MS/MS进行分析鉴别。
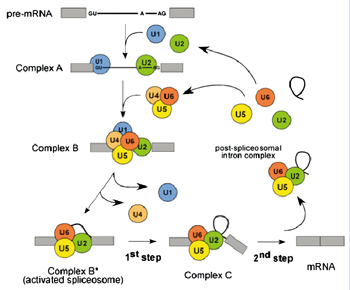
图3. 人体mRNA剪拼体的几个功能性阶段,在蛋白质剪切过程中,可以确定剪拼体(A、B、B*和C)在不同功能阶段的体外生物化学物质,这些复杂的物质存在很大的差异,不仅是体现在主蛋白组分,而且还体现在暂时组装的剪拼因子之中。
鉴定过程共进行两次实验,约30多种蛋白质被鉴定出来,已鉴定的蛋白质如表1所示,其中红色标注的蛋白又通过MIDASTM确认。两次实验结果相比较,重叠率低于75%。许多在第一次实验中被鉴定但可信度较低的蛋白质,第二次实验中并未产生更多的MS/MS图谱,没被再次鉴定出来,增加了鉴定与验证确认的难度。例如:在第一次实验中被鉴定的蛋白质RBM17 (RNA binding motif protein 17)(表1,#24),其鉴定结果仅被一个高分值的多肽(LLQSQLQVK)所支持,并经人工分析后鉴定出来(如图4所示)。但在第二次实验中,该蛋白质并没有被再次鉴定。此例说明需要更可靠的方法来验证并确认它在样本中是否真实存在。此应用实例中,选择表1中红色标示的4个蛋白质进行MIDASTM验证,确认其是否真实存在于样本中。
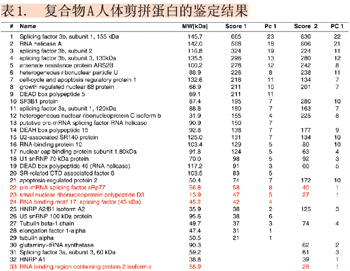
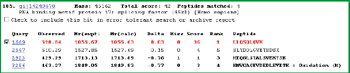
图4. 被鉴定的蛋白质RBM17,其鉴定结果仅被第一次LC-MS/MS实验的一个高分值的多肽所支持。
实验方法
样品制备
样品根据以前的方法制备[6]。简要的说,mRNA剪拼体复合物通过亲和纯化,而后通过甘油梯度离心后,样本被分离成亚复合物。这些亚复合物经过SDS-PAGE分离后,用考马斯亮蓝染色。整个样本电泳泳道用胰蛋白酶进行?位酶解后,萃取并冻干酶切产物肽段。
高效液相色谱分离
酶切产物肽段用纳升级液相色谱(LC Packing 整机系统,Dionex公司)分离。经过C18预柱脱盐后,通过C18分析柱(75mm×15cm, PepMap, Dionex)分离。分离条件:5%~40%乙腈,0.1%甲酸,流速200nl/min,60min梯度洗脱。
MIDASTM工作流程设计器
每一个需要被进一步确认的蛋白质,其胰蛋白酶酶切后的肽段作为母离子被Q1选择出来,经过Q2碎裂后,在Q3中高特异性的检测其碎片离子。只有当上述三个四级杆的扫描条件同时满足时,信号才被记录。因此,上述MRM扫描模式是LC-MS/MS在复杂体系样本中最灵敏且选择性最高的检测技术。由于每个MRM传输只需5~50ms的驻留时间(Dwell time),所以一次运行中可以同时检测多达300个分析物,大量不同的多肽可以同时被扫描检测(如图5所示)。

图5. MRM引导的MIDASTM工作流程图,所有预期的胰酶酶切蛋白质所产生的多肽通过MRM扫描模式监测,验证其是否存在,一旦信号被检测到,仪器会立刻自动切换到高灵敏度MS/MS采集,从而确认蛋白质的真实性。
胰蛋白酶酶切后的多肽与它们的碎片离子所构成的母-子离子对,可以通过MIDASTM工作流程设计器软件计算出来。根据用户输入的蛋白质序列,此软件可自动计算并构建MRM扫描模式所需的母/子离子对,且不需要合成多肽或蛋白质参照物来设计MRM扫描条件。
质谱配合MIDASTM方法检测
使用NanoSpray离子源配合4000 QTRAP
LC-MS/MS进行MIDASTM检测。
数据库检索参数
验证过程中使用MASCOT 1.9(Matrixscience Ltd.)数据库检索引擎,检索NCBInr蛋白质数据库。简要参数设置如下:MS tolerance 0.2,MS/MS tolerance 0.3,Missed cleavages 0,No variable modefications。
结果
目标蛋白质验证与确认结果
此实验中所选择的4个蛋白质,MIDASTM工作流程设计器计算得出83个母/子离子对用于分析。此83个母/子离子对在实际LC-MS/MS实验中不断地被检测到(如图6上图所示)。实验中,一旦MRM扫描出现信号,指示有多肽母离子从色谱柱中洗脱出来,质谱仪立即切换至MS/MS扫描模式(每个肽段母离子,最多采集3次MS/MS图谱数据),采集到的数据经数据库检索后,用于再次确认洗脱下来的多肽是否是来自预期的蛋白质。
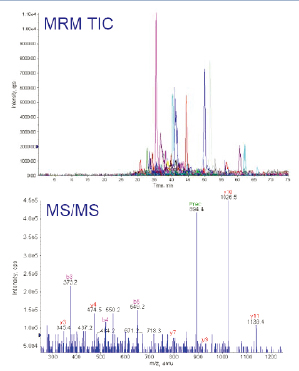
图6. MIDASTM工作流程确认实验,通过83个母/子离子的提取离子质量色谱图(XIC)确认4个蛋白质(上图),得到双电荷m/z894.4的MS/MS谱图的碎片离子确认RBM17的多肽序列为CVIFEIPGAPDDEAVR(下图)。
由于线性离子阱具有极高的灵敏度,即使在MRM扫描中非常低的离子信号,在线性离子阱MS/MS扫描中也可以获得高质量的MS/MS图谱来验证确认蛋白质。如图6下图所示,即使是丰度很低的肽段(CVIFEIPGAPDDEAVR),它的MS/MS图谱质量仍然很好,可以清晰地看到从脯氨酸氨基端碎裂而形成的y10离子。
数据库检索结果
通过MIDASTM方法,样本中被选择进行验证与确认工作的4个低丰度蛋白质都以高分值被验证,每个被确认的蛋白质MASCOT分值都高于100(图7上图所示)。蛋白质RBM17,被5个高分值的多肽所确认。其氨基酸覆盖率达到13.7%(图7)。
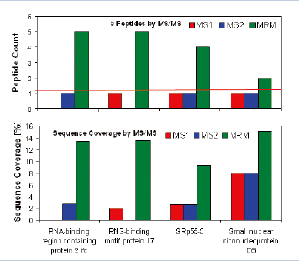
图7. 在MASCO检索结果中4个低丰度蛋白质都以高分值被验证(上图)。此外,蛋白质RBM17被5个分值都大于15的多肽序列所确认(下图)。
由于MIDASTM工作流程的高选择性与灵敏度,即便是在常规Nano-LC-MS/MS实验中模糊的鉴定结果,都可以准确地被验证其在样本中是否真实存在,避免了假阳性的结果,如图8所示。
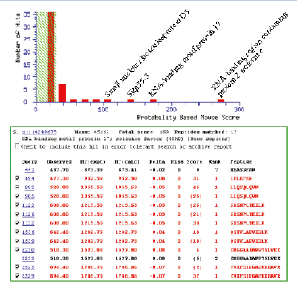
图8. 4种目标蛋白质确认结果总结,蓝色和红色柱状图为标准LC-MS/MS 实验,绿色为MIDASTM工作流程确认结果。
结论
由于MRM采集方式的高选择性与灵敏度,非常适合在动态变化且体系复杂的样本中验证低丰度蛋白质的存在。
在此项实验中,结合4000 QTRAP线性离子阱串联三级四极杆质谱系统,基于MRM的MIDASTM技术方案成功验证了低丰度的4个蛋白质确实存在于人体mRNA剪拼体复合物中。与常规Nano-LC-MS/MS质谱仪蛋白质鉴定实验相比,由MRM引导的线性离子阱MS/MS扫描显著提高了氨基酸覆盖率,增强了可信度与准确性(图8)。
MIDASTM技术方案充分利用了QTRAP这类(线性离子阱串联三级四极杆)质谱系统的功能特点,既通过其三级四极杆的MRM扫描模式验证存在性,又利用其线性离子阱MS/MS扫描灵敏度高的特点确认真实性。因此,MIDASTM技术方法将在生物标志物的验证与确认领域发挥越来越重要的作用。
【参考文献】
1. Baldwin MA, Mol. Cell. Proteomics 3, 1-9 (2005).
2. Panchaud A, Kussmann M and Affolter M, Proteomics 5, 3836-46 (2005).
3. Chamrad DC, koerting G, Stühler K, Meyer HE, Klose J and Blüggel M, Proteomics 4, 619-28 (2004).
4. Unwin RD, Griffiths JR, Leverentz MK, Grallert A, Hagan IM and Whetton AD, Mol. Cell. Proteomics 4, 1134-1144 (2005).
5. Cox DM, Zhong F, Du M, Duchoslav E, Sakuma T and McDermott JC, J. Biomol. Tech. 16,83-90 (2005).
6. Hartmuth K, Urlaub H, Vornlocher HP, Will CL, Gentzel M, Wilm M and Lührmann R, PNAS 99, 16719-24 (2000)
《实验与分析》
展源
何发
热点文章
-
【干货】革兰氏染色的原理、步骤、误区及结果判读!
2025-09-28
-
【干货】如何进行氢氧化钠溶液的标定!
2025-10-14
-
【细看】常见26种试剂的危害与防护!
2025-09-29
-
【必看】实验室安全分类分级你都了解了吗?
2025-11-17
-
【谨记】实验室安全“四不”要牢记!
2025-11-10
-
实验室危险源如何辨识?!
2025-09-22
-
紫外杀菌灯的原理、使用及维护
2025-10-31
-
安捷伦在中国:加速本土创新与绿色发展的双重推进
谈及2024年安捷伦大中华区的业绩表现,杨挺表示,尽管在2023年和2024年全球经济增速放缓,安捷伦中国的业绩仍稳步增长,尤其在制药、食品、环境等行业展现出强劲的市场需求。未来,随着中国科技创新和绿色发展政策的持续推进,安捷伦将继续深化在中国的布局,进一步推动本土化创新。 总结 2024年安捷伦媒体沟通会不仅展示了安捷伦在液相色谱领域的创新成果,也体现了公司在中国市场的深耕与战略部署。
作者:张明
-
洞察未来,共谋发展 “ 数·智·未来 ” 安捷伦未来实验室媒体圆桌会成功举办
-
食品检验理化常用国家标准与要点
-
水分测定方法开发研究&检测相关问题故障分析解决解读
-
药物常用的晶型表征方法









评论
加载更多