二维液相色谱与高分辨质谱联用表征分析抗体偶联药物(ADC)
鉴于这些生物分子固有的复杂性,在线二维液相色谱(LC-LC)成为一种有吸引力的技术用于解决ADC 表征面临的挑战。与传统的一维液相色谱技术 (1D-LC) 相比,LC-LC 结合了两种不同的互补分离系统。在 ADC 分析的背景下,LC-LC 已被证明是一种快速的和高效的分析工具:(1) 通过增加总峰容量来提供更高的分离能力从而允许在单次运行中获得更多信息; (2) 允许进行质谱分析(MS) 与一些与 MS 不兼容的色谱技术耦合,从而促进ADC的结构解析。在本文中,我们将介绍不同色谱的耦合技术,包括疏水相互作用色谱 (HIC)、反相液相色谱 (RPLC)、尺寸排阻色谱 (SEC)、离子交换色谱 (IEX) 和亲水液相色谱 (HILIC)。HIC-SEC、SEC-SEC、HIC-RPLC、IEX-RPLC、RPLC-RPLC 和 HILIC-RPLC,均与高分辨率质谱联用(HRMS),在 ADC 的表征背景下进行讨论。
前言

抗体偶联药物(ADC)是一类最有前途的人类癌症治疗药物。强效的细胞毒性药物,通过稳定的连接子与mAb共价结合。该治疗性生物分子旨在提高治疗效果,同时降低经典化疗的副作用。
通过识别微变异体、3D结构、载药和偶联位点,研究它们对抗原结合、药代动力学、药效学、稳定性,同时也证明ADC的制造及稳定性可以在临床研究的框架下进行,根据关键质量属性(cqa)进行管理,以确保治疗效果和患者安全。
从结构的角度来看,由于ADC的高度复杂性,对其进行完整的表征是一项具有挑战性的任务。除了初始单抗的异质性,偶联策略还带来了额外程度的可变性。在本文中,我们将重点关注两种上市的ADC,布伦妥昔单抗维多汀和阿多曲妥珠单抗伊姆坦辛,它们分别是基于半胱氨酸和赖氨酸偶联的ADC。布伦妥昔单抗是通过细胞毒素与单克隆抗体的化学偶联,通过减少形成链间二硫键的半胱氨酸残基,然后将产生的游离硫醇与药物偶联制成。这一过程导致偶联产物的群体异质性,每个抗体含有不同数量的药物,通常为偶数(0,2,4,6,8)。在阿多曲妥珠单抗的案例中,偶联发生在赖氨酸的氨基上。由于有80-100个赖氨酸可用(而链间半胱氨酸只有8个),与半胱氨酸偶联相比,赖氨酸偶联导致了更不均匀的物种混合,尽管每个抗体结合的药物总体水平相似(在0到8之间,平均为3-4)。
面对这种高度异质性药物,需要大量的分析表征技术。液相色谱(LC)和高分辨率质谱(HRMS)是最常用的工具,因为它们允许在非变性和变性条件下获得样品信息,同时使用完整的、自上而下的、中间向上的(蛋白质水平)和自下而上的方法(肽水平)进行分析。例如,离子交换色谱法(IEX)、尺寸排除色谱法(SEC)、疏水相互作用色谱法(HIC)和亲水相互作用液相色谱法(HILIC)分别可用于研究电荷变体、蛋白质聚集、药物载荷分布和糖型。反相液相色谱(RPLC)与HRMS相结合是目前通过肽图谱(自下而上法)获得蛋白质初级结构的首选技术,通过消解获得的肽段(中向上法)进行分离和鉴定。离子迁移(IM)与MS组合也可以用来表征分析蛋白质构象变化。
尽管有这么多的分析技术,但仍有一些挑战需要解决,例如:1,提高分离能力,促进MS对样品进行深入分析比较;2,交叉来自不同技术的数据,使用大量的盐(HIC, IEX和SEC)进行色谱技术,MS兼容等问题需要研究者去解决。
在线二维液相色谱技术可以用来解决这些问题。(a)两两正交的技术结合起来,可以大大提高峰值容量;(b)允许第一维度与MS直接耦合,意味着第二维度与MS兼容维度;(c)避免离线样品处理从而防止样品丢失;(d)在一次测试中交叉使用两种不同技术提供的信息,同时减少样本消耗。
本文将重点介绍几种不同的二维液相色谱技术,用于ADC分析。1.非变性条件下:HIC-SEC-IM-MS 、SEC-SEC-IM-MS 。变性条件下:HIC-RPLC-UV-MS、IEX-RPLC-UV-MS、HILIC-RPLC-UV-MS 。可以获得单抗异质性信息、药物抗体偶联比(DAR)以及偶联位点。利用RPLC-RPLC-MS, IEX-RPLC-MS, HILIC-RPLC-MS 可以在多肽水平分析ADC 。
二维液相色谱法原理

二维液相色谱的主要概念是:在第一个维度中获得的组分分离转移到第二个色谱柱进行第二次分离。理想情况下,所有未解析的分析物都会进一步被分离。为了成功地实现这一目标,两个耦合分离维度必须通过对化合物提供不同的选择性而相互补充。第一分离系统称为第一维,记为1D,第二分离系统称为第二维,记为2D。在二维LC系统中,二维可以离线耦合,也可以在线耦合。在离线模式下,第一维度分离的组分被收集并储存在小瓶中,后续再次注入到第二维度。同一个仪器(泵系统,样品管理器和检测器)可以通过改变固定相和/或流动相来实现这两个维度。在线模式下,样品的收集、转运、再回注可以做到实时连续进行。具体如图1所示:
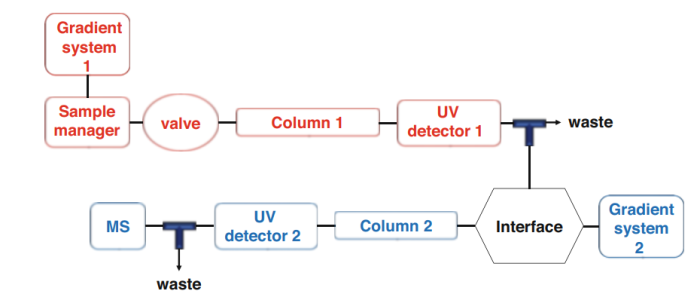
图1.在线二维LC-UV/HRMS仪器通用连接示意图
与离线方法相比,在线方法更有优势,因为它避免了样品丢失、样品污染和样品降解的风险,而且更省时。但是,由于两个维度的相互依赖,在线样本处理可能会导致更加复杂的发生。因此,必须对每一维度都需要开发和优化特定的方法。
如图2所示:二维液相方法主要可以分为以下模式。
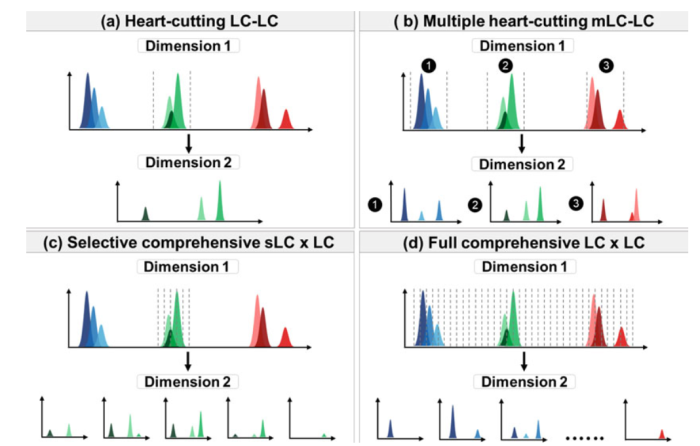
图2.(a)heart-cutting,(b) multiple heartcutting,(c) selective comprehensive,(d) full comprehensive
在完整水平上对ADC表征需要使用非变性分析技术保持蛋白质的结构和构象。变性条件包括物理参数(热、pH值、辐射等)及化学参数(还原剂如二硫苏糖醇(DTT),强酸或强碱,高有机溶剂含量),可能导致ADC亚基之间的弱非共价结合的解离和蛋白质的三维结构的破坏。各种色谱技术基本上是在水溶剂中进行的,因此,适合在完整水平上进行单克隆抗体或ADC分析。包括:HIC、IEX、CEX、SEC。
HIC-SEC

自上而下的方法,从完整的形式开始分析蛋白质,是获取ADC样品纯度信息的强大技术。HIC与紫外检测器联用(UV)是分离链间半胱氨酸偶联ADCDAR值(药物-抗体比)的金标准。对于半胱氨酸连接的ADC,由于蛋白质上存在4个二硫键,偶联过程通常会形成每个抗体平均含有0、2、4、6或8个药物的DAR物种(图3所示)。
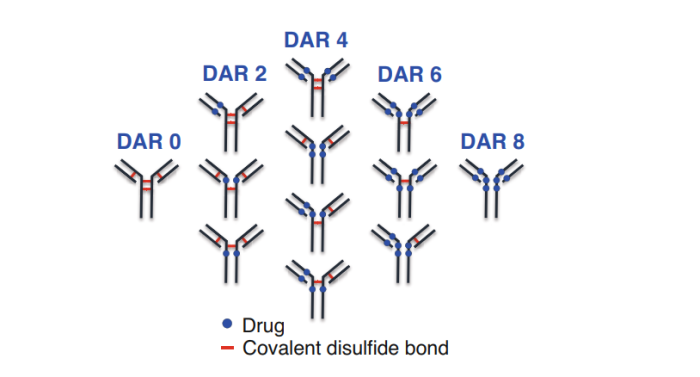
图3.由半胱氨酸偶联药物产生的可能的位置异构体示意图
在ADC偶联中,需要注意的是,DAR0被认为是一种杂质,因为没有药物链接,而DAR为奇数(DAR 1, DAR 3…)的产物为降解产物。对ADC样品中不同DAR值组分的精确表征在质量控制中至关重要,因为不同的异构体可能具有不同的毒理学和/或药代动力学特性,因此可能会影响ADC的总体疗效和安全性。在HIC中,蛋白质通过与固定相表面配体的疏水相互作用被分离。因此,随着蛋白疏水性的增加,保留时间也随之增加。与单克隆抗体相比,单抗上的疏水载荷(或药物)的结合导致疏水性增加。在HIC中,ADC可以通过增加偶联载荷来分离,不同的DAR值组分,疏水性不同。此外,蛋白质结构的变化,包括翻译后修饰(PTMs),如脱酰胺和氧化,甚至糖基化都可以通过HIC进行区分,因为这些变化直接影响分子的整体疏水性。HIC与质谱(尤其是HRMS)结合,是一个强大的工具。单独使用HIC,峰值重叠或分辨率较低会丢失一些信息,而单独使用HRMS则不能区分同一DAR的不同位置异构体(或异构体)。HIC与非变性MS在线耦合用于分离DAR组分,对ADC的表征很有意义。然而,HIC中的分离需要在流动相中使用高浓度的非挥发性盐缓冲液,这与MS检测不兼容。收集HIC馏分,然后进行后续的样品处理,以消除样品中的非挥发性盐,然后MS兼容的溶剂中重新溶解,再回注到HRMS。然而这种离线分离费时费力,样品制备需多次进样,难以实现自动化,这是ADC研发背景下高通量分析的主要缺点。从这个角度来看,二维液相色谱是一个巧妙的解决方案,通过在二维中加入在线快速脱盐步骤,实现HIC与MS的直接结合。为了有一个有效的分析技术,第二维度必须与质谱检测兼容,必须使用非变性条件,以保持蛋白质的完整。图4为HIC-SEC-IM-MS组合分析半胱氨酸偶联的ADC。
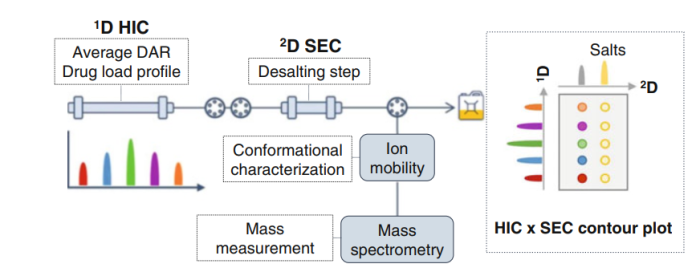
图4.HIC-SEC-IM-MS组合分析半胱氨酸偶联示意图
LC-LC是2个独立的LC系统,两者通过两个6通阀连接。在HIC第一维度,以2.5 M醋酸铵和0.1 M磷酸盐缓冲液为流动相梯度分离不同DAR组分。如此高的挥发性盐浓度,加上使用不挥发性磷酸盐缓冲液,使得HIC与MS不可能直接相连。在第二维度,可以使用SEC作为一个简单的脱盐步骤和一种更兼容的流动相(100 mM醋酸铵)。在此配置中,SEC作为基于尺寸的分离,被用作MS之前的快速在线脱盐步骤,从而允许低分子量HIC盐(MW<100 Da)和高分子量ADC亚型(MW>150 kDa)之间的分离。
除了使用HRMS鉴定结构峰外,可以采用离子迁移谱(IMS)鉴定各组分的构象均匀性。单独的HRMS是无法做到这一点的。一维LC中,所有峰的鉴定都只是基于保留时间。如图5所示。通过HIC-SEC-IM-MS 组合鉴定出相同DAR值组分异构体的存在。此外,进入电离源的ADC,MS的灵敏度显著提高,从而提高了对微量物质的检测,如DAR0和DAR8。
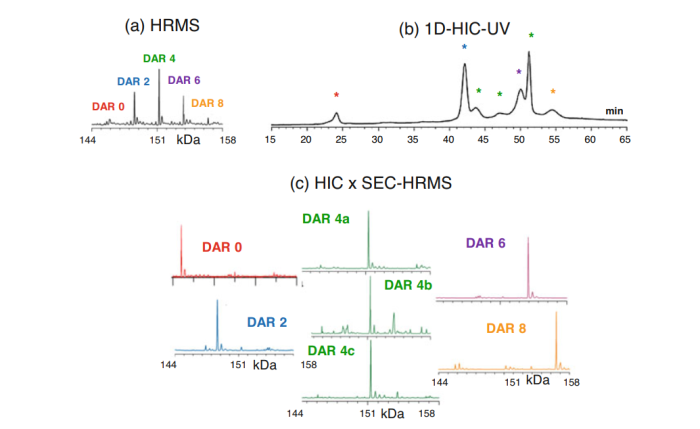
图5.HIC-SEC-IM-MS 组合鉴定出相同DAR值组分异构体的存在
SEC-SEC

对于ADC而言,除了DAR值分析外,聚体分析也是ADC的一个重要质量属性。单抗或ADC样品中尺寸异质性的表征主要依赖于SEC和非变性MS。与HIC相反,SEC可以用挥发性盐或非挥发性盐进行,但据报道,使用挥发性的盐(例如,乙酸铵缓冲液)SEC分离性能低于非挥发性的盐。使用挥发性盐,SEC峰会变宽,且保留时间延长。使用SEC-SEC,第一维SEC为非挥发性盐(磷酸盐,氯化钠),第二维为挥发性盐(醋酸铵)。如图6所示:SEC-SEC-IM-MS ,该方法可以鉴定出仅用SEC无法鉴别出的组分。
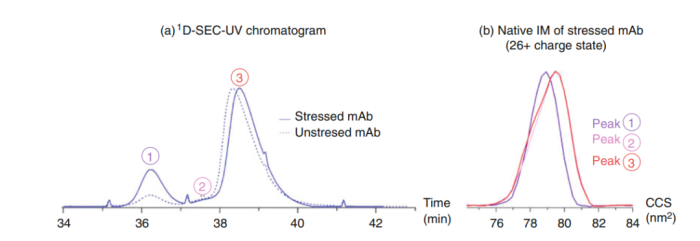
图6.SEC-SEC-IM-MS 分析ADC聚体
由图6(a)可以看到,峰1和峰2在单体峰3前被洗脱。可以被认为是聚体(HMWS)。但是,通过MS发现,他们的分子量一样,均为单体,不是二聚体或者多聚体。但是,虽然都为单体,通过IMS可以看到,他们有不同的构象。将SEC分离提供的信息与原MS中完整质量测量的信息以及IMS提供的CCS值相结合,可以对单体及聚体同时分析。
变性条件或还原条件下分析ADC

非变性HIC和CEX可以保持蛋白结构。通过变性分离(例如RPLC)产生二维蛋白质亚基,以获得先前分离物种的更多结构信息。
HIC-RPLC

HIC-SEC、SEC-SEC中,2维SEC只是起到一个脱盐的作用,然而二维RPLC可以自上而下提供更多的峰信息。在RPLC中,由于变性条件(酸性pH,高有机含量,高温等) ,在半胱氨酸连接的ADC中,会导致弱非共价键的解离,从而形成更小的亚基。在HRMS之前和HIC、SEC或CEX之后的2D RPLC可以对分离的物种进行更精确的结构解析。HIC-RPLC-UV-HRMS,一维HIC分离不同DAR值的物质,二维RPLC提供MS兼容体系(0.05%三氟乙酸+0.1%甲酸水/乙腈)。可以去除第一维度HIC中使用的非挥发性盐(2.5 M乙酸铵和0.1 M磷酸盐缓冲液),二维液相中将盐以废液形式排出(图4所示)。为得到更好的分离效果。需要对1维和2维方法进行优化。主要包括注射溶剂的性质、固定相、盐的类型、盐的浓度和梯度条件。例如可以在一维液相流动相中增加盐浓度来降低其洗脱能力以改善峰型。对于二维液相,降低溶剂效应尤为重要。不相容的流动相可能导致峰展宽甚至峰变形,进而导致整体峰容量和峰强度的降低。HIC-RPLC-UV-HRMS方法可以识别到不同DAR值组分的位置异构体。图7所示。HIC分离后,样品进入RPLC,在RPLC的变性条件下,ADC分为亚基结构,并根据疏水性进行分离。分离产物经MS鉴定。DAR6的四个预期亚基的存在表明DAR6的两个位置异构体被明确识别。
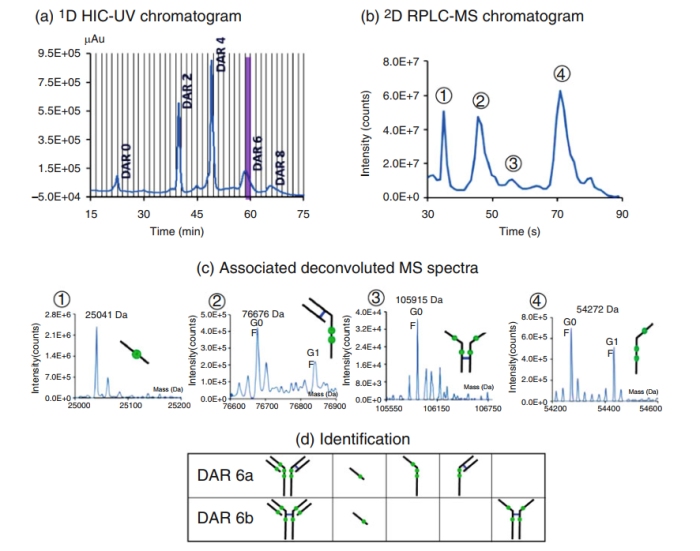
图7.HIC-RPLC-UV-HRMS在线识别不同DAR物种的连续步骤。a)第一维度HIC-UV分离(紫色虚线区域对应第二次维度发送的比例)。(b)上述组分的二维RPLC-MSTIC色谱图。(c) 4个标记峰的反卷积质谱,可以识别4个亚基。(d)将这些亚基归入DAR6的两种不同亚型。
这种方法也可以识别到奇数的DAR。等高线如图8所示:奇偶DAR的结构解析,水平虚线表示在HIC中分离的DAR种类,垂直虚线表示在RPLC中分离的不同亚单位。
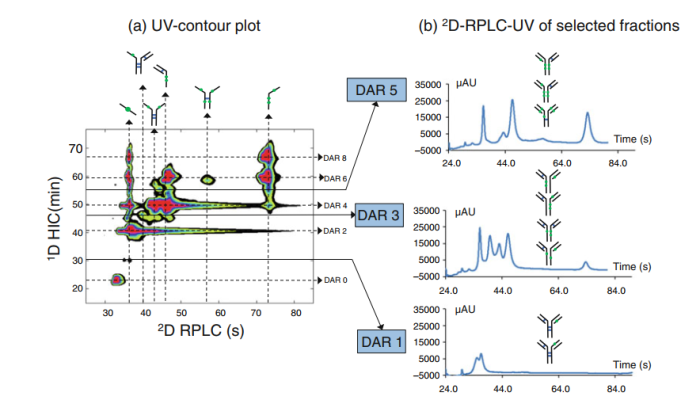
图8.利用HIC-RPLC-HRMS对brentuximab vedotin奇数DAR值的结构解析。(a)经过HIC-RPLC分离的紫外斑点。在RPLC中分离出来的亚单元在等高线图的顶部;等高线图右侧显示HIC中分离出的DAR种类。(b)2维液相及MS鉴定出DAR值为1、3、5的物质。
奇数DARs(1,3和5)及其相关的位置异构体可以被明确识别。在MS检测中,非常大的亚基(MW >100 kDa)难以电离。然而,通过保留时间和MS数据的信息可以预测不同亚基的保留时间。如图9所示,不同亚基的保留时间与药物载量之间的关系。亚基保留时间与偶联药物数量之间具有良好的线性关系。 从这些拟合直线,可以预测任何未识别亚基的保留时间。通过图10所示的2D-UV轮廓图,可以快速进行不合格批次和合格批次之间的可视化比较。
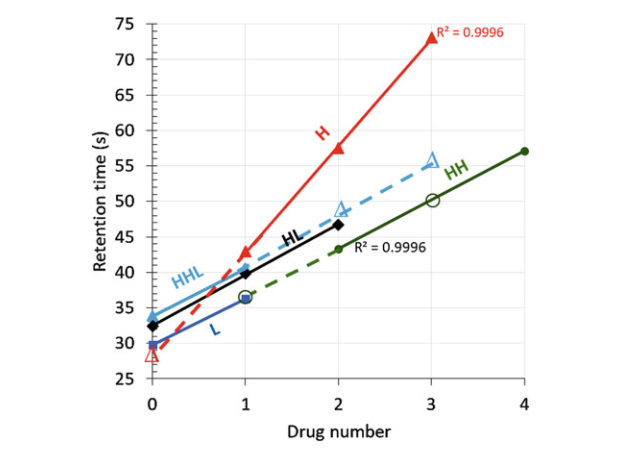
图9.已识别亚基(实心符号)的保留时间图与药物载量的函数关系,在RPLC中预测未识别亚基(空心符号)。HL和H线性系数良好(有3个确定的亚单位)。
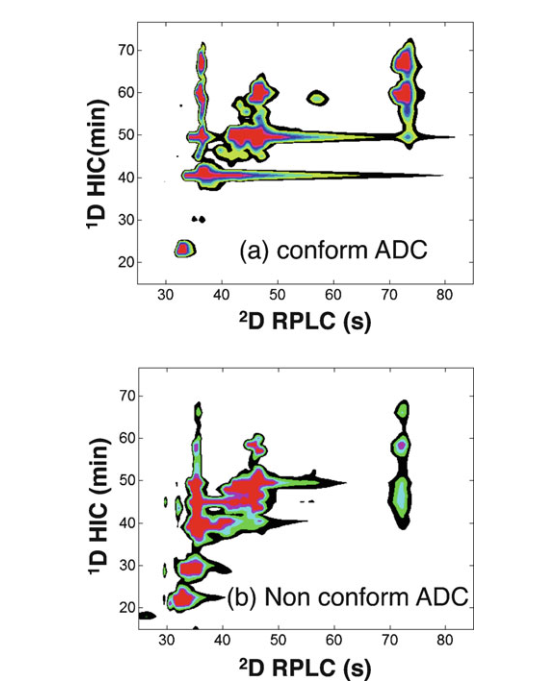
图10.HIC-RPLC-UV 分离brentuximab vedotin非降解和降解2个月的斑点图,可以快速进行不合格批次和合格批次之间的可视化比较
CEX-RPLC

CEX也常与RPLC结合用于ADC分析。CEX用来分析电荷异构体。CEX需要流动相盐缓冲液,通常与MS不兼容。因此,RPLC的首要作用是在MS之前去除盐。每个赖氨酸偶联的ADC,赖氨酸残基去除一个正电荷,导致药物偶联赖氨酸时保留时间降低。药物结合形式、糖链变异、脱酰胺或氧化都可以改变整体电荷,从而改变保留时间。而在RPLC中,偶联疏水小分子后,保留时间延长。DAR值越大,在CEX中保留越短,在RPLC中保留越长。结合保留时间及MS数据,可以评估从DAR0到DAR8的药物载量分布。
HILIC-RPLC

虽然HILIC牵涉到使用高变性的流动相(高有机含量,通常pH值为酸性或碱性),但是这种技术对单克隆抗体或ADC分析很有诱惑力。在HILIC中,化合物通过其亲水性、极性和/或电荷分离。因此HILIC可以被认为是RPLC的一个很好的补充。单抗和ADC的糖基化谱是CQA的一部分,必须在工艺开发过程中进行监测,因为它可能会影响蛋白质的稳定性、有效性和安全性。一维HILIC可以根据糖聚糖的大小来区分蛋白质糖型。在蛋白质分析中,HILIC通常需要在流动相中使用三氟乙酸(TFA)作为离子配对剂,以保持良好的峰形。然而,与甲酸等较弱的酸相比,TFA会导致蛋白质质谱信号降低。巧妙的是,第二维RPLC由于流动相中有甲酸,又可以提高MS信号。此外,考虑到这两种色谱模式的内在互补性,在HILIC分离后加入RPLC的意义在于通过增加分离覆盖获得更多被分离物质的信息。在实验过程中,由于两者流动相之间溶剂强度不匹配,HILIC和RPLC组合有一定难度。可以在RPLC注射前用弱溶剂在线稀释第一维溶剂,避免对分离的影响。图11为CEX-RPLC和HILIC-RPLC的比较。HILIC-RPLC对高度糖基化物种的糖型分离具有更强的选择性(见图中箭头部分)。
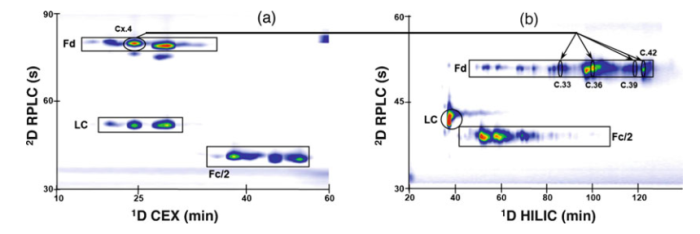
图11.CEX-RPLC(a)与HILIC-RPLC(b) 在线分析rituximab 对比图
RPLC-RPLC

自下而上的方法,也被称为肽图谱。蛋白质经过完全消化(通常用胰蛋白酶),产生小的肽片段。与中间向上方法不同,自下而上的方法用于获得关于氨基酸序列和翻译后修饰或偶联及修饰具体位置的更精确的信息。对于非常大的蛋白质,如单克隆抗体或ADC,胰蛋白酶消化会产生大量的多肽。图12为使用两种不同在线LC-LC-UV-HRMS方法分析单抗和ADC。以获得关于蛋白质上共轭位点的结构信息。其中12a、12b中RPLC-RPLC流动相为10mm碳酸氢钠(pH8.2),0.1%甲酸。
12c、12d中HILIC-RPLC流动相为10mm醋酸铵,0.1%甲酸。在RPLC-RPLC和HILIC-RPLC中,裸抗和ADC的肽图有很大一部分是相同的,因为他们很多肽段是相同的。但是有一些不同的点出现(黑圈部分),基本上位于肽图的顶部。很可能是由于偶联导致的。但是对于HILIC-RPLC而言,这种差异分离的更好。
在对RPLC- RPLC、HILIC-RPLC、SCX-RPLC的对比中发现。在SCX中峰较宽,尽管保留空间覆盖较大,但总体峰值容量降低。HILIC-RPLC的效果没有RPLC-RPLC好, 因为为了克服HILIC溶剂的影响,从HILIC转移到RPLC的量很少。然而与SCX相比,HILIC展示了更好的分辨率,再次体现了在单克隆抗体或ADC特性表征上的巨大潜力。
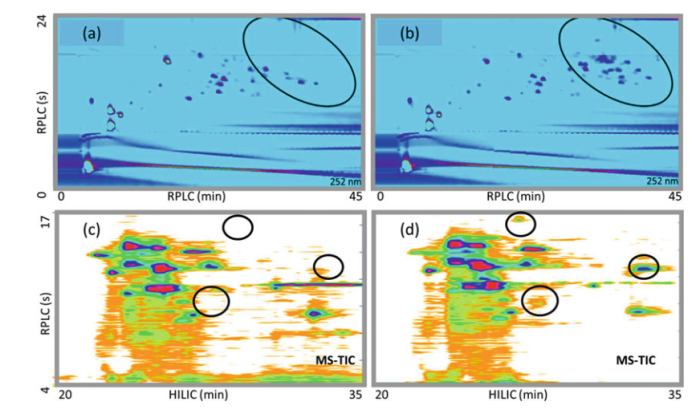
图12.RPLC-RPLC-UV 肽图谱:(a)曲妥单抗,(b) 曲妥单抗ADC;HILIC-RPLC-MS-TIC 肽图谱:(c)本妥昔单抗,(d)本妥昔单抗ADC。mAb和ADC的区别用黑色圈出来
总结

抗体偶联药物是复杂的异质性药物。其固有的复杂性需要多种互补的分析方法来对其表征,其中包括LC和MS。与1维相比,2维液相是一种非常有吸引力的技术,因为它可以结合两种色谱分离,从而最大限度地提高在一次分析中获得的信息。不同的正交组合在ADC的表征上体现着不同的价值。其中包括HIC -SEC、SEC-SEC、 HIC-RPLC、CEX-RPLC、HILIC-RPLC 和 RPLC-RPLC。2D-LC可作为一种快速的方法,通过在第二维度提供脱盐步骤,使不兼容的色谱可以与质谱在线连接,例如,使用HIC、SEC、CEX作为第一维度。此外,通过增加色谱分离空间,第二维度提供了前组分更多的信息。多功能二维在线液相连接HRMS 和 IMS,正在成为表征分析ADC的强大工具。
关于ADC表征研究的问题,大家可以随时私信小编,我们一起交流、学习、进步。
参考文献 1.Soraya Chapel,Two-Dimensional Liquid Chromatography Coupled to High-Resolution Mass Spectrometry for the Analysis of ADCs,168-188. 2.Beck A, Reichert JM (2014) Antibody-drug conjugates: present and future. MAbs 6:15–17. 3.Ehkirch A,Cianferani S (2018) A novel online four dimensional SECSEC-IMMS methodology for characterization of monoclonal antibody size variants. Anal Chem 90:13929–13937. 4.Campuzano IDG(2018) Native-MS analysis of monoclonal antibody conjugates by Fourier transform ion cyclotron resonance mass spec trometry. Anal Chem 90:745–751. 5.Sandra P, Sandra K (2015) Comprehensive two-dimensional liquid chromatography of therapeutic monoclonal antibody digests. Anal Bioanal Chem 407:355–366. |
研学Biotech
展源
何发
相关文章
-

液相色谱-质谱联用技术在兽药残留分析中的应用
2020-10-27
-

气相色谱质谱联用仪的维护与保养
2021-02-22
-
二维液相色谱-高分辨质谱检测平台SEC-RPLC-QTOF轻松鉴定抗生素中聚合物杂质
2021-07-16
-
反相高效液相色谱与质谱联用法分析合成七肽的消旋产物
2020-09-11
-
手性色谱与质谱联用对精神药物的精准检测
2020-05-27
-

液相色谱-高分辨质谱技术在中药代谢研究中的应用
2018-09-13
-
二维液相色谱及其扩展技术在食品、药品以及环境中的应用
2020-03-24
-

气相色谱质谱联用仪的维护指南
2022-10-24
-

超高效液相色谱三重四极杆质谱联用检测猪肉中大环内酯类抗生素
2020-05-27

加载更多