Molecular Cell|魏文胜团队实现人类蛋白质组中赖氨酸位点的功能解码
2023年11月22日,北京大学生命科学学院魏文胜教授团队在Molecular Cell杂志在线发表了题为“Unbiased interrogation offunctional lysine residues in human proteome”的研究论文。该研究采用腺嘌呤碱基编辑工具,建立了一种在全蛋白质组范围内筛选功能性氨基酸位点的策略,并通过细胞适应性筛选,获得了蛋白质组功能性赖氨酸位点的图谱。
在人类蛋白质组众多的氨基酸残基中,研究者首先关注了赖氨酸。赖氨酸残基携带正电荷,在蛋白质的结构、与其他分子的相互作用等方面发挥着重要作用,同时也是多种蛋白质翻译后修饰(如泛素化、乙酰化、甲基化)的重要受体氨基酸残基。赖氨酸的密码子为5’-AAA或5’-AAG,利用腺嘌呤编辑器(Adenine base editors, ABEs)对其密码子进行编辑,可以实现赖氨酸的定向突变(图1)。

图1. 赖氨酸定向突变示意图
该研究利用ABEmax系统在人视网膜色素上皮细胞系RPE1中构建了靶向赖氨酸位点的sgRNA文库3,包含约30万条sgRNA,覆盖了85%的编码基因、85%的蛋白质以及35%的赖氨酸密码子。为提高筛选质量并大幅缩减建库所需细胞数量,研究者结合团队前期建立的iBAR策略进行了细胞适应性筛选4,最终获得了1572个促进或抑制细胞存活的赖氨酸突变位点。
基于课题组前期在RPE1细胞系中进行的基因敲除筛选结果5,研究者将赖氨酸位点的得分映射到其所在基因上,形成了基因(蛋白)-赖氨酸位点的功能性图谱(图2)。值得注意的是,大量赖氨酸位点的突变导致细胞表现出与相应基因敲除不同的细胞适应性表型。在这些突变位点中,有805个位点突变后会抑制细胞存活,然而对应的基因敲除却未对细胞存活产生影响或促进细胞存活。通过对国际癌症基因组联盟数据库(ICGC)的数据挖掘,研究者鉴定了若干具有临床意义的赖氨酸突变位点,包括已有报道的TP53-K120、BRAF-K601、PTEN-K13等位点,然而大多数赖氨酸位点的功能仍不为人知。
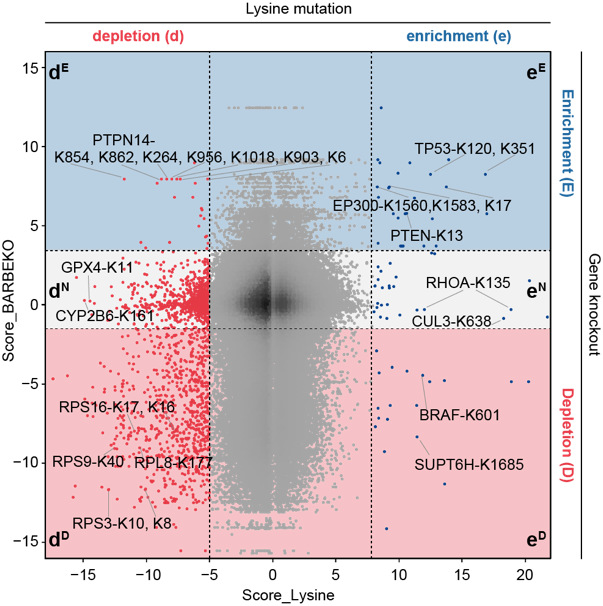
图2. 两种筛选结果对比图
在正向富集的赖氨酸位点中,研究者发现了一个以CUL3为核心的调控网络。CUL3是泛素化复合物(cullin-RING ligases,CRLs)中的重要成员。该研究筛选到位于其骨架蛋白、接头蛋白、激活蛋白、底物蛋白多个赖氨酸位点(图3)。通过亲和纯化-质谱等方法,研究者发现CUL3-K638E能够显著削弱CUL3和去nedd化复合物(COP9 signalosome,CSN)的结合,导致其持续处于nedd化状态而最终降低了稳定性。
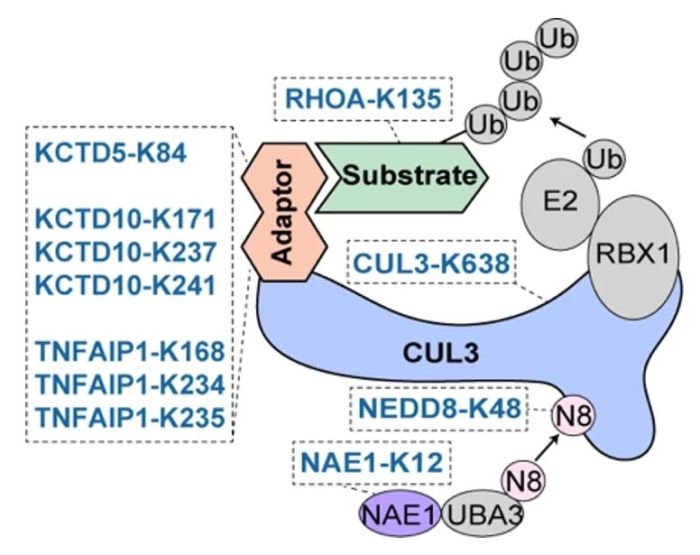
图3. CUL3 CRLs复合物
最终,研究者将关注点聚焦在CUL3的接头蛋白KCTD10的K171位点上,该位点在一名乳腺癌患者体内检测到了突变(K171E)。通过一系列实验,研究者证实KCTD10-K171能够发生乙酰化修饰,并通过调控细胞周期蛋白TPX2和INCENP的蛋白稳态来控制下游信号通路,确保细胞周期正常进行。KCTD10-K171的突变可能导致细胞周期蛋白无法正常降解,从而引起细胞过度增殖。该位点可能成为潜在的癌症标志突变,有助于癌症的诊断和预后,并为新药研发提供指导。
总的来说,本研究利用碱基编辑技术成功建立了高通量的氨基酸精度功能性筛选方法,为系统性研究蛋白质功能和调控机制提供了新的有效手段。同时,所得到的氨基酸精度的蛋白质功能性大数据为更深入地理解蛋白质调控机制,尤其是翻译后修饰机制,提供了有力的依据(图4)。
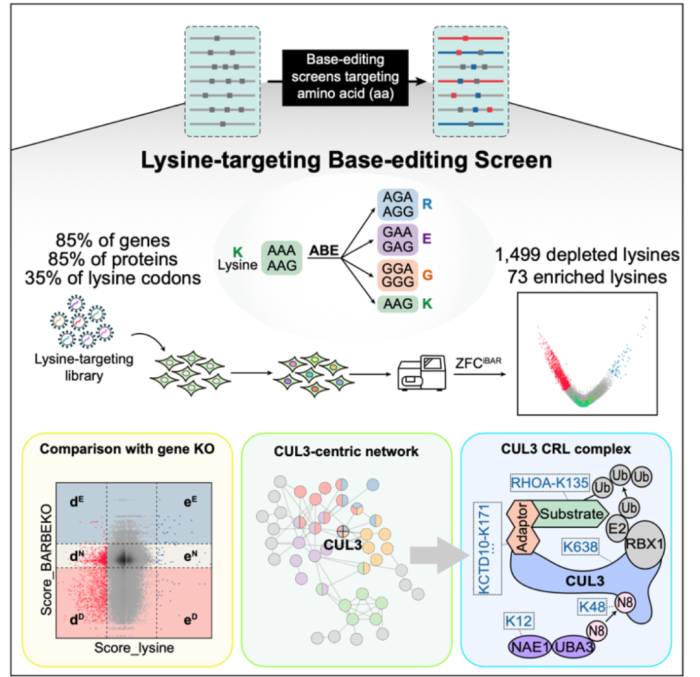
图4. 总结图
魏文胜课题组博士后宝颖、博士研究生潘倩和已毕业的许萍博士和刘志恒博士为论文的共同第一作者,魏文胜和副研究员周卓(现为中国医学科学院系统医学研究院/苏州系统医学研究所研究员)为论文的共同通讯作者。该研究获得了国家重点研发计划、国家自然科学基金、北京市科委生物医学前沿创新推进项目、中国医学科学院医学与健康科技创新工程、北大-清华生命科学联合中心、北京昌平实验室、重大疾病共性机制研究全国重点实验室等的支持。
参考文献:
1. Komor, A.C., Kim, Y.B., Packer, M.S., Zuris, J.A., and Liu, D.R. (2016). Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature 533, 420–424. 10.1038/nature 17946.
2. Gaudelli, N.M., Komor, A.C., Rees, H.A., Packer, M.S., Badran, A.H., Bryson, D.I., and Liu, D.R. (2017). Programmable base editing of A•T to G•C in genomic DNA without DNA cleavage. Nature 551, 464–471. 10.1038/nature 24644.
3. Koblan, L.W., Doman, J.L., Wilson, C., Levy, J.M., Tay, T., Newby, G.A., Maianti, J.P., Raguram, A., and Liu, D.R. (2018). Improving cytidine and adenine base editors by expression optimization and ancestral reconstruction. Nat. Biotechnol. 36, 843–846. 10.1038/nbt.4172.
4. Zhu, S., Cao, Z., Liu, Z., He, Y., Wang, Y., Yuan, P., Li, W., Tian, F., Bao, Y., and Wei, W. (2019). Guide RNAs with embedded barcodes boost CRISPR-pooled screens. Genome Biol. 20. 10.1186/s13059-019-1628-0.
5. Xu, P., Liu, Z., Liu, Y., Ma, H., Xu, Y., Bao, Y., Zhu, S., Cao, Z., Wu, Z., Zhou, Z., et al. (2021). Genome-wide interrogation of gene functions through base editor screens empowered by barcoded sgRNAs. Nat. Biotechnol. 10.1038/s41587-021-00944-1.
Bioon细胞
展源
何发
热点文章
-
【必看】实验室安全分类分级你都了解了吗?
2025-11-17
-
【必看】1分钟看懂qPCR曲线图
2025-11-27
-
气相色谱法科普知识
2025-11-18
-
【小知识】实验室单位换算!
2025-12-22
-
【必看】生物安全实验室分类
2025-12-18
-
GB/T 18242-2025 弹性体/塑性体改性沥青防水卷材
2025-12-05
-
【收藏】实验室易制毒、易制爆的化学品
2025-12-16
-
独立百天,新生启航:Solstice Advanced Materials中国首秀,锚定先进计算、可持续发展、生命科学新航道
2026年1月末,距离从霍尼韦尔正式分拆独立,并在纳斯达克挂牌上市将满百日时,全新的特种材料公司 Solstice Advanced Materials在上海举办了其独立运营后的首次中国媒体见面会。
作者:张明
-
安捷伦在中国:加速本土创新与绿色发展的双重推进
-
洞察未来,共谋发展 “ 数·智·未来 ” 安捷伦未来实验室媒体圆桌会成功举办
-
食品检验理化常用国家标准与要点
-
水分测定方法开发研究&检测相关问题故障分析解决解读
-
药物常用的晶型表征方法









评论
加载更多